Structure de carbonate de lithium (LI2CO3), propriétés, utilisations

- 2073
- 88
- Lucas Schneider
Il carbonate de lithium C'est un solide inorganique formé par deux lithium Li+ et un carbonate anion co32-. Sa formule chimique est Li2CO3. Le li2CO3 Il s'agit d'un solide cristallin blanc qui peut être obtenu par la réaction entre l'hydroxyde de lithium et le dioxyde de carbone.
Le carbonate de lithium a un point de fusion très élevé, il est donc utilisé dans la préparation du verre, de la céramique et de la porcelaine. Il a des utilisations très variées, telles que des batteries au lithium rechargeables, dans la préparation d'autres composés au lithium, des électrodes de soudage et dans des peintures et des vernis.
 Carbonate de lithium Li2CO3 solide. Photo prise par W: Utilisateur: Walkerma en juin 2005. Source: Wikimedia Commons.
Carbonate de lithium Li2CO3 solide. Photo prise par W: Utilisateur: Walkerma en juin 2005. Source: Wikimedia Commons. Li est également utilisé2CO3 Dans des mélanges de ciment pour obtenir des réglages rapides et une production d'aluminium.
L'une de ses utilisations les plus importantes est le traitement de certaines maladies mentales telles que la dépression et les comportements excessivement agressifs, entre autres conditions.
Cependant, son utilisation en tant que médicament doit être dûment contrôlée par des médecins spécialistes parce que les personnes traitées avec Li2CO3 Ils peuvent subir des effets nocifs pour la santé, comme l'hypothyroïdie (fonction réduite de la glande thyroïde).
[TOC]
Structure
Le carbonate de lithium est composé de deux lithium Li+ et un carbonate anion co32-.
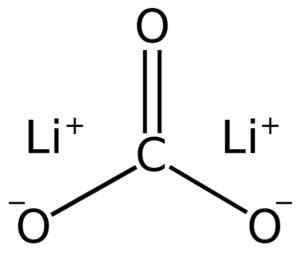 Structure de carbonate de lii lithium2CO3. Adrian Hands [Domaine public]. Source: Wikimedia Commons.
Structure de carbonate de lii lithium2CO3. Adrian Hands [Domaine public]. Source: Wikimedia Commons. La configuration électronique du lithium à l'état d'oxydation +1 est 12 2s0, Eh bien, il a perdu l'électron de la dernière couche, étant ainsi plus stable. Le carbonate ion co32- Il a une structure plate.
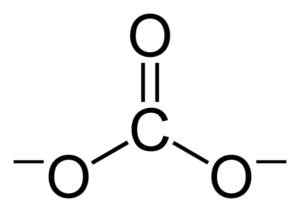 Structure plate du charbon ion co32-. Benjah-bmm27 [domaine public]. Source: Wikimedia Commons.
Structure plate du charbon ion co32-. Benjah-bmm27 [domaine public]. Source: Wikimedia Commons. Les charges négatives sont réparties également entre les trois atomes d'oxygène de l'ion charbon32-.
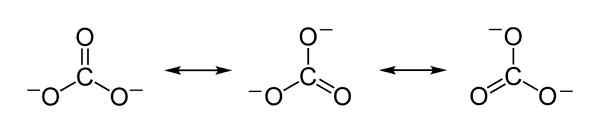 Structures de résonance théoriques du carbonate ion co32- qui sert à expliquer la distribution équitable des charges négatives entre les 3 atomes d'oxygène. Benjah-bmm27 [domaine public]. Source: Wikimedia Commons.
Structures de résonance théoriques du carbonate ion co32- qui sert à expliquer la distribution équitable des charges négatives entre les 3 atomes d'oxygène. Benjah-bmm27 [domaine public]. Source: Wikimedia Commons. Nomenclature
-Carbonate de lithium
-Carbonate de diliation
Propriétés physiques
État physique
Solide blanc cristallin de structure monoclinique
Poids moléculaire
73,9 g / mol
Point de fusion
723 ºC
Décomposition
Il se décompose à 1300 ºC.
Densité
2,11 g / cm3
Solubilité
Peu soluble dans l'eau: 1,31% en poids à 20 ºC. Sa solubilité dans l'eau diminue à mesure que la température augmente. Il est soluble dans les acides dilués. Il est insoluble dans l'alcool et l'acétone.
Peut vous servir: oxyde de baryum (Bao): structure, propriétés, utilisations, risquespH
Les solutions d'eau sont alcalines, elles ont un pH supérieur à 7.
Propriétés chimiques
Le li2CO3 Il est hydrolysé en solution aqueuse générant une solution de base. La petite proportion du composé qui est solubilisé dans l'eau laisse le carbonate anion co-libre32-.
Le carbonate anion co32- Libre en solution aqueuse prend un proton pour former l'anion bicarbonate HCO3-, Comme on peut le voir dans la réaction suivante:
CO32- + H2O → HCO3- + Oh-
La présence d'ions OH- C'est ce qui rend la solution de base.
Propriétés biologiques
Dans les tissus animaux et humains, il y a normalement des traces de lithium -on, mais jusqu'au moment, aucun rôle physiologique naturel de cet ion n'est connu.
Dans l'organisme humain, le li2CO3 Ingéré comme médicament, agit sur une variété de mécanismes de signalisation dans les neurones et autres cellules. Il résulte du remplacement de cations telles que le sodium et le potassium.
L'incorporation de l'ion lithium dans la structure de la membrane cellulaire peut modifier la réponse aux hormones et le couplage cellulaire avec des processus énergétiques.
De cette façon, le lithium modifie plusieurs processus cellulaires, y compris le métabolisme.
Par la modification de la façon dont les cellules fonctionnent2CO3 Vous pouvez agir sur les mécanismes de communication des neurones dans le cerveau.
Obtention
Le li2CO3 Il peut être obtenu par la réaction d'hydroxyde de lithium avec le dioxyde de carbone CO2, Comme indiqué ci-dessous:
2 lioh + co2 → Li2CO3 + H2SOIT
Le commerce se produit dans le commerce à partir de minéraux contenant du lithium tels que le spot. Ces minéraux sont traités à des températures élevées avec certains sels de sulfate ou avec des composés alcalins pour obtenir des sels de lithium.
Les sels de lithium obtenus sont purifiés avec des solutions d'eau ou d'acide, puis elles sont traitées avec des carbonates pour former Li2CO3.
Cependant, le Li2CO3 L'accompagnement est contaminé par des sulfates ou des chlorures de calcium, du magnésium, du fer, du sodium, du potassium, etc. Nécessitent donc une purification ultérieure.
Applications
Dans le traitement des maladies mentales
Il est utilisé comme agent antidépresseur et antimaniaque, dans le traitement des comportements agressifs-impulsifs et des troubles bipolaires (les personnes qui changent soudainement leur humour sans aucune cause, devenant violente).
Peut vous servir: 20 exemples de sublimation chimique et de caractéristiques Certains troubles agressifs-impulsifs peuvent être traités avec Li2CO3. Auteur: Prawny. Source: Pixabay.
Certains troubles agressifs-impulsifs peuvent être traités avec Li2CO3. Auteur: Prawny. Source: Pixabay. Les médecins ont observé que leur administration entraîne une diminution de l'intensité et de la fréquence des périodes graves de dépression et d'épisodes maniaques.
Il est utilisé seul, c'est-à-dire sans aucun composé supplémentaire, dans la thérapie d'entretien de la dépression unipolaire et pour le trouble schizoécique. Il sert également à augmenter l'effet antidépresseur d'autres médicaments.
Bien qu'il ait été utilisé pour traiter les enfants présentant des symptômes apparents de trouble bipolaire et d'hyperactivité avec des composants névrotiques ou agressifs, il n'a pas été efficace dans tous les cas.
Dans le traitement des symptômes d'autres maladies
Il est utilisé pour réduire la fréquence des maux de tête forts, récurrents et chroniques.
Il est utilisé pour réduire l'incidence de l'infection chez les patients atteints de neutropénie induite par la chimiothérapie ou d'autres raisons. La neutropénie est la diminution des neutrophiles, un type de globules blancs qui aident à lutter contre les infections dans le corps.
Il a été utilisé comme inhibiteur de l'enzyme thyroïdienne pour le traitement de l'hyperthyroïdie, mais ce n'est pas un traitement préféré en raison de ses effets indésirables.
Forme d'administration
Il est utilisé sous forme de tablettes ou de capsules Li2CO3. Également dans des comprimés à libération lente avec du citrate de lithium. Li est préféré2CO3 Parce qu'il n'irrite pas la gorge lors de la déglutition, comme cela se produit avec d'autres sels de lithium.
 Auteur: Pete Lyforth. Source: Pixabay.
Auteur: Pete Lyforth. Source: Pixabay. Effets indésirables
Le li2CO3 Il peut avoir un effet nocif sur la thyroïde et les reins, de sorte que la fonction de ces organes doit être surveillée avant et pendant le traitement avec ce composé.
Le li2CO3 Il peut être toxique à des concentrations très proches de celles employées dans des traitements médicaux, donc un examen continu de leurs valeurs de sérum sanguin est requise.
Symptômes d'empoisonnement Li2CO3 Ce sont des tremblements, des spasmes musculaires, une faiblesse musculaire, une diarrhée, des vomissements, une somnolence ou une ataxie (détérioration de la coordination musculaire), entre autres.
Au début de la liiry2CO3 Des symptômes tels que des tremblements, des maux de tête et des nausées peuvent également se produire. Mais ceux-ci ont tendance à disparaître en poursuivant des médicaments.
Peut vous servir: HolmioLa plupart des personnes traitées peuvent également développer une leucocytose (augmentation du nombre de globules blancs), mais c'est réversible.
Les gens qui sont médicamentés avec Li2CO3 Ils ne devraient pas gérer les véhicules ou faire fonctionner des machines, car il diminue la coordination physique et la capacité d'effectuer des activités qui doivent être alertes.
Cas dans lesquels il ne doit pas être administré
Il ne doit pas être utilisé chez les enfants de moins de 12 ans, car il peut interférer avec la formation d'os et leur densité, car il modifie les concentrations d'une hormone thyroïdienne. Il a également tendance à occuper le lieu du calcium dans les os.
Ils ne doivent pas être traités avec Li2CO3 Personnes atteintes de maladies cardiovasculaires, de reins ou de thyroïde. Ni chez les patients gravement déshydratés.
Les femmes enceintes ne doivent pas être administrées surtout au cours du premier trimestre de la grossesse. Le lithium traverse le placenta et peut atteindre facilement le fœtus avec des effets tératogènes possibles, c'est-à-dire qu'il peut produire des anomalies ou des malformations dans le bébé qui se brasse.
Personnes âgées qui ont besoin d'un traitement avec li2CO3 Ils doivent être traités avec grand soin et avec des doses inférieures à celles des jeunes adultes, car ils peuvent développer une maladie de l'hypothyroïdie.
Autres utilisations
Le li2CO3 La haute pureté est largement utilisée dans la fabrication de batteries rechargeables au lithium.
Il est utilisé dans les piles à combustible en carbonate en fusion.
Il est utilisé dans la fabrication de porcelaine électrique qui est un type de porcelaine d'isolation électrique. Il est également utilisé dans la production de vitrage sur la céramique.
 Le li2CO3 Il est utilisé pour fabriquer de la porcelaine électrique, qui est utilisée comme isolant d'électricité, par exemple dans les poteaux électriques. Fir0002 Flagstoffotos [à] Gmail.com Canon 20D + Tamron 28-75 mm f / 2.8 [gfdl 1.2 (http: // www.gnou.Org / licences / anciens licences / fdl-1.2.html)]. Source: Wikimedia Commons.
Le li2CO3 Il est utilisé pour fabriquer de la porcelaine électrique, qui est utilisée comme isolant d'électricité, par exemple dans les poteaux électriques. Fir0002 Flagstoffotos [à] Gmail.com Canon 20D + Tamron 28-75 mm f / 2.8 [gfdl 1.2 (http: // www.gnou.Org / licences / anciens licences / fdl-1.2.html)]. Source: Wikimedia Commons. Il permet de préparer des céramiques avec un faible coefficient d'expansion, c'est-à-dire qu'il se développe très peu lors de l'augmentation de la température, de sorte que la céramique peut être utilisée dans un intervalle de température plus élevé.
D'autres utilisations sont comme catalyseur, dans la fabrication d'autres composés au lithium, tels que les électrodes de soudage, dans des formules de peinture luminescentes, des vernis et des colorants, ainsi que dans la production électrolytique en aluminium.
Il est utile pour générer un réglage de ciment plus rapide et s'ajoute à la colle de tuiles afin qu'ils puissent être réparés en peu de temps.
 Auteur: Capri23auto. Source: Pixabay.
Auteur: Capri23auto. Source: Pixabay. Les références
- Cai, w. et al. (2018). Retrait de SO42- de li2CO3 par recristallisation en na2CO3. Crystals 2018, 8, 19. MDPI a récupéré.com.
- Gadikota, G. (2017). Connexion des changements morphologiques et structurels cristallins lors de la conversion du monohydrate d'hydroxyde de lithium en carbonate de lithium à l'aide de mesures de diffusion de rayons X à échelle. Minerals 2017, 7, 169. MDPI a récupéré.com.
- OU.S. Bibliothèque nationale de médecine. (2019). Carbonate de lithium. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement.
- Kirk-othmer (1994). Encyclopédie de la technologie chimique. Quatrième édition. John Wiley & Sons.
- Encyclopédie de la chimie industrielle d'Ullmann. (1990). CINQUIÈME ÉDITION. VCH VERLAGSGELLSCHAFT MBH.
- Coton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley & Sons.
- « Exemples d'angles conjugués internes et externes, exercices
- .Structure de l'acide stéarique (CH3 (CH2) 16COOH), Propriétés, utilisations »

