.Structure de l'acide stéarique (CH3 (CH2) 16COOH), Propriétés, utilisations

- 3489
- 437
- Lucas Schneider
Il acide stéarique C'est un composé organique solide dont la formule chimique est Cho3(Ch2)16COOH. Il s'agit d'un acide carboxylique qui appartient au groupe d'acides gras saturés à longue chaîne. Il est blanc jaunâtre et a une odeur similaire à celle du suif ou de la graisse animale.
Il est appelé acide gras car il est présent dans de nombreuses graisses et huiles d'animaux et de légumes. Il fait partie du métabolisme de la plupart des êtres vivants et est généralement sous la forme de la glycérine ester.
 Acide stéarique solide. Adam Rędzikowski [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikimedia Commons.
Acide stéarique solide. Adam Rędzikowski [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikimedia Commons. Le cacao le possède en grande proportion, ainsi que le suif des bovins, de la graisse de porc et du beurre. Il est également présent dans les huiles végétales comme le maïs. Pour l'obtenir, la Triesarina est hydrolysée, c'est-à-dire qu'elle est traitée avec de l'eau et des alcali.
L'ingestion d'acide stéarique avec de la nourriture et son effet sur la santé présente actuellement des doutes pour les chercheurs. Il semble qu'il ait plus de nocif que les effets bénéfiques.
Il est utile dans la préparation de médicaments, d'emballage d'isolation à l'eau, de bougies de paraffine, de graisses lubrifiantes, de matériaux aux figures de moisissure, de cosmétiques, de pommades, de crèmes, entre autres applications.
[TOC]
Structure
La molécule d'acide stéarique a une chaîne linéaire de 18 atomes de carbone dans lesquels le dernier atome de carbone fait partie d'un groupe carboxylique -cooh. La chaîne de carbone n'a que de simples liaisons C-C car il s'agit d'un acide gras saturé.
Sa formule élargie est:
Ch3-Ch2-Ch2-Ch2-Ch2-Ch2-Ch2-Ch2-Ch2-Ch2-Ch2-Ch2-Ch2-Ch2-Ch2-Ch2-Ch2-COOH
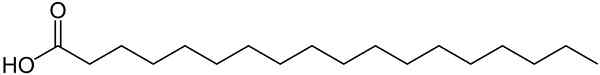 Structure de la molécule d'acide stéarique. Vous pouvez voir sa longue chaîne saturée et le groupe -cooh à la fin. Wolfgang Schaefer [domaine public]. Source: Wikimedia Commons.
Structure de la molécule d'acide stéarique. Vous pouvez voir sa longue chaîne saturée et le groupe -cooh à la fin. Wolfgang Schaefer [domaine public]. Source: Wikimedia Commons. Nomenclature
-Acide stéarique
-Acide octadécanoïque
-Acide stéarophanique
Propriétés physiques
État physique
Blanc massif ou légèrement jaune, cristallin, avec une odeur douce similaire à celle du suif.
Poids moléculaire
284,5 g / mol
Peut vous servir: polyvinylpirrolidone: structure, propriétés, utilisations, effets secondairesPoint de fusion
69,3 ºC
Point d'ébullition
383 ºC
Point d'inflammation
196 ºC (méthode de coupe fermée).
Densité
0,9408 g / cm3 à 20 ºC
Solubilité
Insoluble dans l'eau et flotte sur ce. Légèrement soluble dans l'alcool. Soluble dans l'éther, l'acétone et le chloroforme.
Constante de dissociation
PAQUETpour = 4,75
Propriétés chimiques
L'acide stéarique réagit avec l'hydroxyde de sodium (NaOH) et la forme de sodium sodium qui est un savon. La plupart des savons contiennent du stéarate de sodium.
L'acide stéarique et le stéarate de sodium sont considérés comme des composés généralement sûrs et non toxiques.
Emplacement dans la nature
L'acide stéarique est l'un des constituants de nombreuses huiles et graisses d'origine végétale et animale. Il est généralement sous la forme de son ester de glycérine.
 Graisse de porc. L'un de ses composants est l'acide stéarique. Rasbak [cc by-sa 3.0 (http: // CreativeCommons.Org / licences / by-sa / 3.0 /]]. Source: Wikimedia Commons.
Graisse de porc. L'un de ses composants est l'acide stéarique. Rasbak [cc by-sa 3.0 (http: // CreativeCommons.Org / licences / by-sa / 3.0 /]]. Source: Wikimedia Commons. Il est présent dans de nombreuses graisses solides telles que le sébum et en un moindre pourcentage de graisses semi-solides telles que le beurre de porcs, le beurre et les huiles végétales telles que le maïs et le coton.
 Beurre, aliments contenant de l'acide stéarique. Auteur: CongerSign. Source: Pixabay.
Beurre, aliments contenant de l'acide stéarique. Auteur: CongerSign. Source: Pixabay. C'est un élément important du beurre de cacao (38%) et du karité (arbre africain qui produit un type de noix) (38,1%).
 Graines de cacao. Le beurre de cacao est très riche en acide stéarique. Auteur: dghChocolatier. Source: Pixabay.
Graines de cacao. Le beurre de cacao est très riche en acide stéarique. Auteur: dghChocolatier. Source: Pixabay. Il fait partie du métabolisme de nombreux êtres vivants, comme les plantes, les mammifères, les êtres humains, les crustacés et les algues. Cela signifie que, par exemple, les êtres humains peuvent le synthétiser dans leur organisme.
Effet de l'ingestion d'acide stéarique avec de la nourriture sur la santé humaine
L'acide stéarique, bien qu'il se produise naturellement dans l'organisme humain, est également ingéré avec des aliments qui le contiennent à la fois par leur origine et ajouté à sa composition.
Il convient de noter que parmi les aliments transformés industriellement, ils ont cessé d'utiliser des graisses trans pour être très nocif pour la santé de l'être humain. Ces graisses ont été remplacées par des acides gras saturés, parmi ces acides stéariques.
Il peut vous servir: Rubidio: Historique, propriétés, structure, obtention, utilisationsLes effets de cette substitution sont toujours à l'étude. En général, les acides gras saturés à longue chaîne augmentent les taux de cholestérol à faible densité, qui est lié à la mortalité coronarienne et cardiaque.
Cependant, certaines études indiquent que l'acide stéarique diminue le cholestérol à faible densité, ce qui suggère qu'il a des propriétés antiotogènes, c'est-à-dire qu'elle ne génère pas la formation de plaques dans les artères, mais qu'elle favorise la santé des vaisseaux sanguins.
D'un autre côté, d'autres enquêtes indiquent qu'il a le plus grand potentiel proltrombotique des acides gras saturés à longue chaîne, cela signifie qu'il peut favoriser les capuchons de vaisseaux engourdis.
De plus, il a été déterminé que des niveaux élevés d'acide stéarique dans le sang sont toxiques pour certaines cellules de pancréas, afin qu'ils puissent aggraver les symptômes du diabète de type 2. Cette maladie est courante chez les personnes en surpoids.
 En surpoids. Il n'est pas conseillé d'ingérer des aliments avec de l'acide stéarique car il pourrait générer ou augmenter la maladie du diabète de type 2. Auteur: Sedatgunduz. Source: Pixabay.
En surpoids. Il n'est pas conseillé d'ingérer des aliments avec de l'acide stéarique car il pourrait générer ou augmenter la maladie du diabète de type 2. Auteur: Sedatgunduz. Source: Pixabay. C'est pour ces raisons que ses effets continuent d'étudier car il n'a pas été possible de clarifier si leur action est favorable à la santé de l'organisme humain.
Obtention
Il peut être obtenu par hydrolyse de la glycérine ou du stéarate de trisharine C3H5(COOC17H35)3, Selon la réaction chimique suivante:
Triesarine + hydroxyde de sodium → Stéarate de sodium + glycérine
Pour le produire commercialement, l'hydrogénation des acides gras insaturés de 18 carbones est effectuée, comme le contenu dans les graines de coton et autres légumes.
En d'autres termes, l'hydrogène est ajouté aux doubles liaisons C = C des acides gras insaturés, étant comme de simples liaisons C-C, comme indiqué ci-dessous:
-Ch = ch- + h2 → -ch2-Ch2-
Il peut vous servir: Cyclohexen: structure, propriétés, synthèse et utilisationsApplications
Dans plusieurs applications
L'acide stéarique est un composé chimique commercial important.
Il est utilisé dans l'industrie pharmaceutique pour la fabrication de divers médicaments, tels que les suppositoires, les pilules couvertes pour les conditions intestinales ou pour couvrir les remèdes amers, entre autres. C'est aussi un ingrédient de pommades ou de onguents.
Pour être insoluble dans l'eau, il est utilisé dans l'industrie alimentaire pour les emballages isolants et dans la préparation de divers types de matériaux imperméables.
Il est également utilisé comme ingrédient dans les gélatines, les puddines, les bonbons et les boissons non alcoolisées parce qu'ils leur donnent une viscosité.
Il est utilisé dans la fabrication de bougies de stéarine et est ajouté à la cire de paraffine en petites quantités. En raison de sa texture, il est également utilisé dans les matériaux moulables qui servent à fabriquer des modèles trois dimensions.
Il sert également dans des revêtements d'électricité statiques.
Son sel de sodium est un savon et est également utilisé pour le durcissement du savon. Étant un composé inoffensif pour l'être humain, il est utilisé pour fabriquer des cosmétiques, comme l'agent émollient ou graissé de crèmes. Il sert également à adoucir les plastiques.
 Les savons contiennent généralement du stéarate de sodium qui est un dérivé de l'acide stéarique. Auteur: Theresaharris10. Source: Pixabay.
Les savons contiennent généralement du stéarate de sodium qui est un dérivé de l'acide stéarique. Auteur: Theresaharris10. Source: Pixabay.  Les crèmes cosmétiques contiennent souvent de l'acide stéarique. Auteur: PhotosForyou. Source: Pixabay.
Les crèmes cosmétiques contiennent souvent de l'acide stéarique. Auteur: PhotosForyou. Source: Pixabay. L'acide stéarique est utilisé pour préparer d'autres composés chimiques tels que certains stéats métalliques, par exemple celui de l'aluminium, qui est utilisé pour faire des graisses lubrifiantes en épaissant les huiles qui les composent.
De plus, c'est un ingrédient de certains pesticides, il est utilisé dans les séchoirs de vernis et comme activateur de vulcanisation en caoutchouc synthétique.
Pour attraper la maladie transmettant les moustiques
L'acide stéarique a été utilisé avec succès dans des pièges à lumière ultraviolette (UV) pour attirer les moustiques transmissibles de la dengue.
Son odeur caractéristique est similaire à celle de l'acide lactique qui est celle de la peau des humains, donc lorsqu'il est placé dans les pièges, il attire les moustiques, qui sont piégés dans l'appareil et meurent.
Les références
- Tvrzicka, e. et al. (2011). Les acides gras comme biocompoubs: leur rôle dans le métabolisme humain, la santé et la maladie - une revue. Partie 1: Classification, sources alimentaires et fonctions biologiques. Biomed Pap Med Fac Univ Palacky Olomouc Tchèque Répub. 2011 juin; 155 (2): 117-130. Biomed récupéré.Upol.CZ.
- Tseng, w.-H. et al. (2019). Conception du dispositif de la lentille de liberté secondaire avec de l'acide stéarique pour le système de piégeage de moustiques à faible lutte. Electronics 2019, 8, 624. MDPI a récupéré.com.
- Encyclopédie de la chimie de Van Nostrand (2005). Acide stéarique et stérarates. Récupéré de la bibliothèque en ligne.Wiley.com.
- OU.S. Bibliothèque nationale de médecine. (2019). Acide stéarique. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement.
- Lu, h. et al. (2016). L'acide stéarique circulant élevé conduit à un effet lipotoxique majeur sur les cellules bêta pancréatiques de souris dans l'hyperlipidamiamia via une voie dépendante de Perk / p53 médiée par miR-34a-5p. Diabetology 2016, 59 (6): 1247-57. NCBI a récupéré.NLM.NIH.Gouvernement.
- « Structure de carbonate de lithium (LI2CO3), propriétés, utilisations
- Biographie de Jerome Bruner, théorie cognitive, contributions, œuvres »

