Chaleur d'évaporation

- 4169
- 249
- Eva Henry
 La chaleur d'évaporation, ou vaporisation, est celle qui souffre d'un produit chimique pour changer l'état liquide au gazeux
La chaleur d'évaporation, ou vaporisation, est celle qui souffre d'un produit chimique pour changer l'état liquide au gazeux Qu'est-ce que la chaleur de l'évaporation?
Il Chaleur d'évaporation, Également appelée chaleur de vaporisation, elle est définie comme la quantité de chaleur qu'une pure chimie absorbe pour évaporer, c'est-à-dire pour subir un changement d'état de l'état liquide à l'état gazeux.
C'est-à-dire que c'est la chaleur associée au prochain processus de changement de phase:
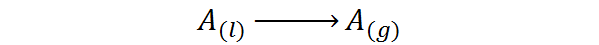
C'est un type de chaleur qui ne génère pas une augmentation de la température, mais brise les forces qui maintiennent les molécules liquides ensemble. De cette façon, il est possible de séparer les molécules les unes des autres, les libérant à la phase gazeuse.
Formule et unités
La chaleur d'évaporation ou de vaporisation peut être représentée au moyen du symbole QVapeur. C'est un montant étendu, c'est-à-dire qu'il dépend de la quantité de substance.
En ce sens, il peut être calculé à partir de la quantité de substance et d'une mesure intensive de la chaleur d'évaporation.
Lorsque la quantité de substance est exprimée sous la forme d'une masse, la chaleur latente d'évaporation ou de vaporisation doit être utilisée, LVapeur, Dans ce cas, la chaleur d'évaporation est exprimée comme suit:
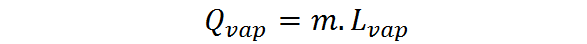
La chaleur latente de la vaporisation est une quantité intensive et caractéristique de chaque substance. C'est une mesure plus ou moins directe de la force des interactions intermoléculaires entre les particules qui composent un liquide.
D'un autre côté, la chaleur de vaporisation peut également être calculée à partir du nombre de moles, auquel cas la chaleur molaire de vaporisation est nécessaire, également appelée enthalpie de vaporisation:
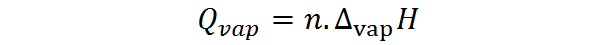
Où n représente le nombre de moles et ∆VapeurH est l'enthalpie de la vaporisation de la substance. L'enthalpie de vaporisation représente la quantité de pression constante nécessaire pour évaporer une mol d'une substance.
Il peut vous servir: acide propaneUnités de chaleur d'évaporation
Étant un type de chaleur, qui est une forme d'énergie, la chaleur d'évaporation est exprimée en unités d'énergie. Les unités les plus couramment utilisées sont:
- Calories (citron vert)
- Kilocalories (kcal ou chaux)
- Joules ou joules (j)
- Kilojouls ou kilojuos (kj), etc.
D'un autre côté, la chaleur latente de l'évaporation (LVapeur) Il est exprimé en unités d'énergie de masse. Par exemple:
- chaux / g
- Kcal / g
- Kcal / kg
- kj / g
- kJ / kg, etc.
Enfin, l'enthalpie de vaporisation (∆VapeurH) Il est exprimé en unités énergétiques sur des unités de quantité de matière, généralement des taupes. Certains exemples sont:
- chaux / mol
- Kcal / mol
- J / mol
- kJ / mol, etc.
Comment la chaleur de l'évaporation est-elle calculée?
Comme nous l'avons vu il y a un instant, la chaleur de l'évaporation peut être calculée à partir de la masse ou du nombre de moles et de la chaleur latente de l'évaporation ou de l'enthalpie de vaporisation, respectivement.
Cependant, ces quantités sont généralement déterminées en mesurant expérimentalement la quantité de chaleur nécessaire pour évaporer une certaine masse d'une substance, puis en nettoyant l'une des deux équations précédentes.
En raison de ce qui précède, la chose commune n'est pas que la chaleur de vaporisation soit calculée, mais qu'elle est mesurée expérimentalement, en laboratoire.
D'un autre côté, puisque l'enthalpie comme la propriété thermodynamique d'un système est une fonction d'état, cela peut être calculé à partir d'autres enthalpies qui se rapportent à une substance dans un état liquide avec la même substance dans un état gazeux.
Par exemple, l'enthalpie de vaporisation peut être calculée en soustrayant l'enthalpie de sublimation, à l'exception de l'enthalpie de fusion d'une substance. Ensuite, cette enthalpie et le nombre de moles sont utilisés pour déterminer la chaleur de l'évaporation de l'échantillon.
Peut vous servir: polychlorure en aluminium: structure, propriétés, obtention, utilisationsApplications de chaleur d'évaporation
Il existe de nombreux champs dans lesquels la chaleur d'évaporation est utilisée. En fait, dans tout processus qui implique un produit chimique qui à un moment donné est à l'état liquide et dans un autre dans un état gazeux, la chaleur de l'évaporation interviendra.
La chaleur de l'évaporation est toujours positive, car il est toujours nécessaire d'absorber la chaleur pour briser l'union entre les molécules qui forment un liquide. La substance absorbe cette chaleur de l'environnement immédiat, de sorte qu'ils perdent de la chaleur lorsqu'un liquide s'évapore.
Régulation de la chaleur et de la température corporelle de l'évaporation
Ceci est le principe de fonctionnement de la transpiration en tant que système de régulation de la température corporelle.
Lorsque nous transpirons, l'eau de sueur s'évapore à la surface de notre peau. Comme la peau est en contact direct avec la sueur, c'est là que l'eau obtient la chaleur de l'évaporation.
Ensuite, lors de l'évaporation, l'eau de sueur transporte avec elle une quantité de chaleur de la peau, qui refroidisse, refroidissant également le sang qui traverse les capillaires de la peau et, finalement, l'intérieur du corps.
Chaleur d'évaporation dans l'industrie
L'énergie est l'un des plus grands coûts pour de nombreuses industries, et beaucoup d'entre eux ont besoin de dépenser de l'énergie pour évaporer différentes substances. Pour cette raison, être en mesure de calculer la quantité de chaleur nécessaire pour évaporer différents liquides est nécessaire pour calculer les coûts d'exploitation.
Par exemple, si une entreprise pharmaceutique synthétise un médicament dans une solution alcoolique, il devra probablement évaporer et sécher le produit pour éliminer tout l'alcool. La chaleur de l'évaporation nous permet de déterminer la quantité d'énergie nécessaire pour effectuer ce.
Il peut vous servir: acide périódique (HIO4): qu'est-ce que la structure, les propriétés, les utilisationsFabrication de glace dans un train
Avant l'existence de l'électricité, les trains ont utilisé la chaleur d'évaporation pour geler l'eau et donc faire de la glace pendant le voyage. Le processus est similaire à la transpiration et fonctionne de la même manière.
À la gare, le train accroche un sac en cuir qui contient de l'eau liquide. Le sac n'est pas parfaitement hermétique, donc l'extérieur est humidifié. Pendant le voyage, l'air évapore rapidement l'eau de la surface du sac, absorbant la chaleur de l'eau liquide et la refroidissant, au point de la congélation.
Exemples de chaleurs d'évaporation
Le tableau suivant contient des chaleurs latentes de vaporisation ou d'évaporation pour certains produits chimiques communs.
| Substance | La chaleur latente de vaporisation (LVapeur/ kj.g-1) | Enthalpie de vaporisation (∆VapeurH/ kj.mol-1) |
| Eau (h2SOIT) | 2 260 | 40 657 |
| Éthanol (ch3Ch2OH) | 0,837 | 38,56 |
| Sulfure d'hydrogène (h2S) | 0,6422 | 21.90 |
Les références
- Ehu.C'est (s. F.). Chaleur latente de la vaporisation de l'eau. Tiré de SC.Ehu.est.
- Luz, G. (s. F.). Chaleur de vaporisation. Tiré des matériaux.Gelsonluz.com.
- Soler & Palau (2019). Chaleur latente: fusion et vaporisation. Tiré de Solerpalau.com.
- Spiegato (2021). Quelle est la chaleur de vaporisation? Pris de Spiegato.com.

