Poids équivalent
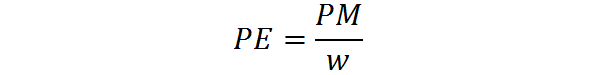
- 3617
- 799
- Raphaël Meyer
Quel est le poids équivalent?
Il Poids équivalent C'est le poids ou la masse d'un équivalent de substance. C'est-à-dire que c'est le poids ou la masse d'une substance qui est chimiquement égal à 1 mole d'une autre substance du même type qui est utilisée comme modèle de référence et est considérée comme normale.
La substance normale prise comme référence dépend du type de réaction chimique impliquée et du rôle que le composé joue dans cette réaction. Les composés normaux réagissent toujours les uns avec les autres avec la stoechiométrie 1: 1.
Par exemple, si nous parlons d'une réaction acide / base, le poids équivalent d'un acide serait le poids dudit composé équivalent à 1 mole d'un acide normal, qui a un seul proton ionisable.
Avant de savoir que la matière était formée par des atomes et des molécules, une série de lois qui déterminaient la relation de masse (ou le poids) entre les réactifs et les produits d'une réaction chimique avaient déjà été établies.
Ces lois ont formé les bases des calculs stoechiométriques pendant les débuts de la chimie en tant que science.
Le concept de poids équivalent est lié à ce stade précoce du développement de la chimie. Ensuite, nous discuterons de la façon dont il est calculé, à quoi cela sert et quelques exemples courants de votre calcul.
Formule et unités de poids équivalent
Le poids équivalent est calculé à partir du poids moléculaire d'une substance au moyen de la formule suivante:
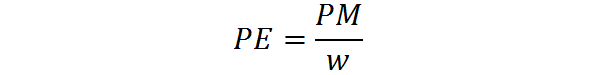
Lorsque PE est le poids équivalent, PM est le poids moléculaire ou la masse molaire de la substance, et W représente le nombre d'équivalents par mole.
Ce dernier se compose toujours d'un entier également ou supérieur à 1. Il représente le nombre de molécules d'un réactif «normal» auquel chaque molécule de substance est équivalente. Par conséquent, cela dépend du type de réactif en question et du type de réaction chimique impliquée.
Peut vous servir: dihydroxyacétone: structure, propriétés, obtention, utilisationsIl peut également être calculé à partir de la pâte, M et du nombre d'équivalent:
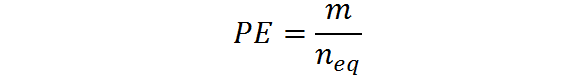
Unités de poids équivalent
Comme on peut le voir à partir de la formule précédente, le poids équivalent est exprimé en unités de masse (généralement grammes) sur le nombre d'équivalent. C'est-à-dire que les unités sont g / eq.
La valeur de W Dans la première formule précédente, il est exprimé en unités équivalentes sur MOL (Eq / Mol), tandis que la masse molaire est exprimée en grammes sur MOL (g / mol).
Quel est le poids équivalent pour?
L'utilité principale du poids équivalent est qu'elle simplifie les calculs stoechiométriques. Le poids équivalent d'une substance équivaut à une autre substance du même type et pour le même type de réaction chimique. En fait, à partir de là, il obtient son nom.
Cela nous permet d'effectuer des calculs stoechiométriques d'une manière très simple et sans avoir besoin d'écrire et d'équilibrer les équations chimiques.
Comment le poids équivalent est-il calculé?
Comme nous l'avons vu auparavant, le poids équivalent est calculé à partir du poids moléculaire et du nombre d'équivalents par mol ou w.
Calcul du poids moléculaire
Le poids moléculaire d'une substance est déterminé en ajoutant le poids atomique de tous les atomes qui le ralentissent. Ces poids atomiques se trouvent dans le tableau périodique.
Détermination de W
La valeur de W Pour une substance, cela dépend du type de réaction dans lequel il est impliqué. Autrement dit, cela dépend du type de réactif en question. Pour chaque type de substance, il existe un moyen différent de déterminer W.
Le tableau suivant montre comment il est déterminé W Pour différents cas.
Il peut vous servir: Hypochlorite de calcium (CA (CLO) 2)| Type de réactif | Valeur de W |
| Acides | Nombre d'hydrogènes ionisables pour chaque molécule acide. |
| Bases | Nombre de protons qui peuvent capturer ou neutraliser chaque molécule de base. |
| Agents oxydants | Nombre d'électrons qui capturent chaque mol d'agent oxydant dans la semi-recueil de réduction. |
| Les agents réducteurs | Nombre d'électrons libérés chaque taupe d'agent réducteur en semi-rétraction d'oxydation. |
| Vous sortez | Nombre total de charges positives ou négatives générées lorsque l'un des sel. |
| Substances neutres | 1 |
Il convient de noter que si une substance peut participer à plus d'un type de réaction chimique, il peut avoir plus d'une valeur de W Et, par conséquent, plus d'un poids équivalent.
Importance et applications du poids équivalent
Le poids équivalent est utilisé pour calculer le nombre d'équivalents d'un produit chimique. Ce nombre d'équivalents est toujours égal au nombre d'équivalents d'une autre substance avec laquelle il réagit.
Ceci est principalement utilisé dans deux zones différentes:
En chimie analytique
Les équivalents sont souvent utilisés pour faciliter les calculs stoechiométriques en chimie analytique. Cela est particulièrement vrai dans le cas d'une analyse volumétrique et gravimétrique.
La connaissance du volume du degré au point d'équivalence et la concentration du titulaire, ainsi que le poids équivalent du droit, permettent facilement de calculer la masse de l'analyte présent dans un échantillon.
En électrolyse
Dans le domaine de l'électrolyse, le poids équivalent représente le poids d'un métal ou d'une autre substance qui peut se produire lorsque 96.500 C chargement par cellule électrolytique. Cela facilite les calculs stoechiométriques et économiques du processus d'électrolyse.
Peut vous servir: oxyde de mercure (hg2o)Exemples du calcul de poids équivalent
Calcium
Le poids atomique du calcium est de 40 et ce métal forme des cations avec Valencia +2, donc son poids équivalent est de 40/2 = 20 g / Eq.
Acide sulfurique (h2Swin4)
Le poids moléculaire de ce composé est de 98 et est un acide diprotique, donc W = 2. Par conséquent, le poids équivalent est PE: 98/2 = 49 g / EQ.
Hydroxyde d'aluminium (AL (OH)3)
L'hydroxyde d'aluminium (PM = 78) est un composé amphoter qui peut agir comme acide et comme une base.
Si vous agissez comme une base en libérant vos trois hydroxydes, alors W = 3, Donc PE: 78/3 = 26 g / EQ. D'un autre côté, lorsqu'il agit comme un acide, il capture une molécule d'eau et libère un proton, donc, dans ce cas, W = 1 et PE = 78 g / EQ.
Phosphate de calcium (CA3(Po4)2)
Le phosphate de calcium est un sel qui, lors de la dissociation, produit 3 ions Ca2+ et 2 ions po43-.
Dans tous les cas, le nombre de charges du même signe que chaque unité de phosphate de calcium produit est 6, donc W = 6 et PE = 310/6 = 51,67 g / Eq.
Les références
- Encyclopédie universelle (S. F.). Poids équivalent. Pris de Encyclopedia_Universal.ES-Academic.com.
- Chimie, chimie inorganique (s. F.). Poids équivalent. Pris de Fullquimica.com.
- Chimie.C'est (s. F.). Équivalent. Tiré de la chimie.est.
- Spiegato (2021). Quel est le poids équivalent? Pris de Spiegato.com.

