Structure de butanale, propriétés, utilisations et risques
- 2693
- 490
- Louna Baron
Il Butanal Il s'agit d'un aldéhyde à chaîne ouverte, composé de quatre atomes de carbone, et est analogue au butane; Il s'agit en fait de la deuxième forme la plus oxydée d'hydrocarbure de butane après l'acide butyrique. Sa formule moléculaire est Cho3Ch2Ch2Cho, où -cho est le groupe formil.
Cet aldéhyde, l'un des plus légers, se compose d'un liquide transparent, inflammable et moins dense que l'eau. De plus, il est soluble dans l'eau et miscible avec la plupart des solvants organiques; Par conséquent, il peut être utilisé pour avoir une seule phase de mélanges organiques.
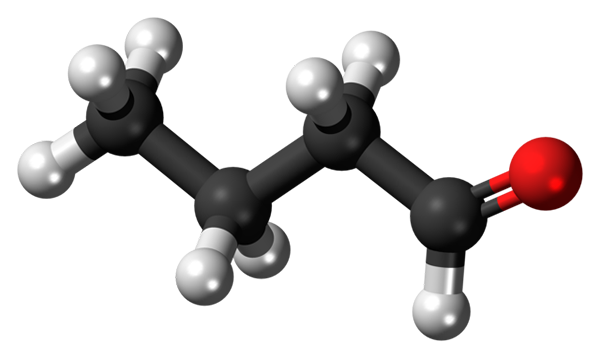
 Molécule de butanal ou butiraldéhyde. Source: Jynto [CC0]
Molécule de butanal ou butiraldéhyde. Source: Jynto [CC0] La présence du groupe carbonyle (celle de la sphère rouge, image supérieure) donne une polarité chimique à la molécule butanale, et donc la capacité de ressentir l'interaction dipol-dipolo entre ses molécules; Bien qu'aucun ponts d'hydrogène ne se forme entre eux.
Cela apporte en conséquence que les points d'ébullition et de fusion actuels du butanal sont supérieurs à celle du butane, mais moins que celles présentées par l'alcool n-boutyle.
Butanal est utilisé comme solvant et est intermédiaire pour obtenir de nombreux produits; comme les accélérateurs de la vulcanisation des caoutchoucs, des résines, des produits pharmaceutiques et agrochimiques.
Le butanal est un composé toxique que l'inhalation peut provoquer une inflammation des voies respiratoires supérieures, l'œdème bronche et pulmonaire qui, même, peut avoir des conséquences fatales.
[TOC]
Structure butanale
Il vient de mentionner que le groupe Formil, -ch. À la suite de cela, leurs molécules peuvent interagir entre elles par les forces dipol-dipolo.
Peut vous servir: séchoir rotatif: fonctionnement, à quoi sert-il, pièces, applicationsDans l'image supérieure, il est montré, avec un modèle de sphères et de barres, que la molécule butanal a une structure linéaire. Le carbone -cho du groupe a une hybridation SP2, tandis que les carbones restants3.
Non seulement cela, mais il est également flexible et leurs liens peuvent tourner sur leurs propres axes; Et donc, différentes conformations ou conformères sont générés (même composé, mais avec leurs liaisons tournées).
Conformères
L'image suivante explique le mieux ce point:
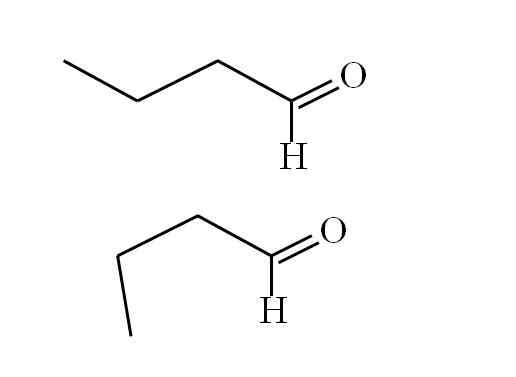 Butanal se conforme. Source: Gabriel Bolívar.
Butanal se conforme. Source: Gabriel Bolívar. Le premier conformère (le supérieur) correspond à la molécule de la première image: le groupe méthyle à gauche, -ch3, et le groupe -cho, sont en position anti-parallèle; L'un pointe, et l'autre en bas, respectivement.
Pendant ce temps, le deuxième conformère (le bas) correspond à la molécule avec le -ch3 et le -ho dans des positions éclipsées; c'est-à-dire que les deux pointent dans la même direction.
Les deux conformères sont rapidement interchangeables, et donc la molécule butanale tourne et vibre constamment; Et a ajouté le fait qu'il a un dipôle permanent, cela permet à ses interactions d'être suffisamment fortes pour bouillir à 74,8 ° C.
Propriétés
Noms chimiques
-Butanal
-Butiraldéhyde
-1-butanal
-Brutal
-N-butiraldéhyde.
Formule moléculaire
C4H8Ou ch3Ch2Ch2Chou.
Aspect physique
C'est un liquide clair et transparent.
Odeur
Odeur caractéristique, acre, aldéhyde.
Point d'ébullition
167 ºF à 760 mmHg (74,8 ºC).
Point de fusion
-146 ºF (-96,86 ºC).
point d'allumage
-8 ºF (-22 ºC) Verre fermée.
Solubilité dans l'eau
7 g / 100 ml à 25 ºC.
Solubilité dans les solvants organiques
Miscible avec l'éthanol, l'éther, l'acétate d'éthyle, l'acétone, le toluène et de nombreux autres solvants organiques.
Densité
0,803 g / cm3 à 68 ºF.
Peut vous servir: Nitrates: propriétés, structure, nomenclature, formationDensité de vapeur
2,5 (dans la relation aérienne prise égale à 1).
La pression de vapeur
111 mmHg à 25 ºC.
Auto-direction
446 ºF. 425 ºF (21,8 ºC).
Gelée
0,45 cpoise à 20 ºC.
Chaleur de combustion
2479,34 kJ / mol à 25 ° C.
Chaleur de vaporisation
33,68 kJ / mol à 25 ° C.
Tension superficielle
29.9 Dina / cm A 24 ºC.
Seuil d'odeur
0,009 ppm.
Indice de réfraction
1 3843 à 20 ºC.
Moment dipolaire
2,72 D.
Longueurs d'onde (λ) d'absorption maximale dans l'eau
225 nm et 282 nm (lumière ultraviolette).
Polymérisation
Le butanal peut polymériser en contact avec des alcalis ou de l'acide, étant une polymérisation dangereuse.
Réactivité
Lorsqu'il est exposé à l'air oxydé, formant l'acide butyrique. À une température de 230 ° C, le butanal est spontanément enflammé de l'air.
Condensation aldolique
Deux molécules butanales peuvent réagir les unes aux autres, en présence de KOH et une température de 6-8 ºC, pour former le composé 2-éthyl-3-hydroxyhexanol. Ce type de composé est appelé Aldol, car il a un groupe aldéhyde et un groupe alcoolique dans sa structure.
La synthèse
Le butanal peut se produire par déshydrogénation catalytique de l'alcool N-butyle; l'hydrogénation catalytique du crotonaldéhyde; et hydroformillation de propylène.
Applications
Industriels
-Butanal est un solvant industriel, mais il est également intermédiaire dans la synthèse d'autres solvants; par exemple le 2-éthylhexanol, le n-butanol et le triméthylpropane.
-Il est également utilisé comme intermédiaire dans l'élaboration des résines synthétiques, parmi lesquelles, le polyvinil butiral; accélérateurs de la vulcanisation du caoutchouc; fabrication de produits pharmaceutiques; produits pour la protection des cultures; pesticides; antioxydants; Assistants de lutte.
-Le butanal est utilisé comme matière première pour l'élaboration des arômes synthétiques. De plus, il est utilisé comme agent aromatisant alimentaire.
Il peut vous servir: bromure de sodium (NABR)Autres
-Chez l'homme, le butanal est utilisé comme biomarqueur indiquant des dommages à l'oxydation, subis par les lipides, les protéines et les acides nucléiques.
-Il a été utilisé expérimentalement, avec le formol et le gluerdéhyde, pour essayer de réduire le ramollissement ressenti par les casques de bœuf, en raison de l'exposition à l'eau, à l'urine et aux excréments de bovins eux-mêmes. Les résultats expérimentaux étaient positifs.
Des risques
Le butanal est destructeur pour les membranes tissulaires muqueuses des voies respiratoires supérieures, ainsi que pour les tissus de la peau et des yeux.
Par contact avec la peau produit des rougeurs et des brûlures. Aux yeux, les mêmes lésions sont produites, accompagnées de douleur et de dommages au tissu oculaire.
L'inhalation de butanal peut avoir de graves conséquences, car elle peut produire dans le larynx et l'inflammation et les bronchiaux d'œdème; Dans les poumons, il produit une pneumonie chimique et un œdème pulmonaire.
Les signes de surexposition comprennent: les sensations d'ardeur sur les voies respiratoires supérieures, la toux, la respiration sifflante, c'est-à-dire l'émission de sifflement lors de la respiration; laryngite, manque de respiration, maux de tête, nausées et aussi vomissements.
L'inhalation peut être mortelle en raison du spasme des routes de réparation.
L'ingestion de butanal provoque une sensation de «brûlure» sur les voies digestives: cavité orale, pharynx, œsophage et estomac.
Les références
- Morrison, R. T. Et Boyd, R. N. (1987). Chimie organique. (5faire Édition.). Éditorial addison-wesley iberoamericana.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Se publier. (2019). Butanal. Récupéré de: pubchem.NCBI.Nim.NIH.Guv
- Wikipédia. (2019). Butanal. Récupéré de: est.Wikipédia.org
- Livre chimique. (2017). Butanal. Récupéré de: Chemicalbook.com
- BASF. (Mai 2017). N-butyraldéhyde. [PDF]. Récupéré de: solvants.BASF.com
- « Caractéristiques, types et exemples du carbone primaires
- Caractéristiques de l'éducation intégrale et comment y parvenir »

