Structure de bifthalate de potassium, nomenclature, utilisations, risques
- 2259
- 558
- Raphaël Charles
Il bifthalate de potassium Il s'agit d'un composé chimique, solide, blanc et soluble, qui est commercialement à l'état de haute pureté. Il est utilisé comme modèle principal pour standardiser les solutions dans les qualifications acides-bases; Il est également utilisé comme solution tampon pour maintenir le pH des solutions stable.
Il s'agit d'un composé stable et non hygroscopique, qui facilite la préparation de la solution car il n'absorbe pas l'eau pendant le processus lourd. Il peut être préparé par la réaction entre l'acide photal.
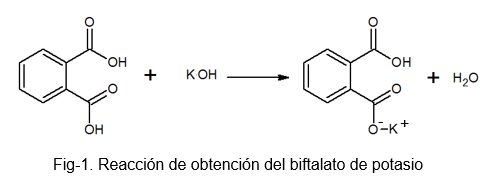
Le bifthalate de potassium reçoit ce nom car dans sa molécule, il y a un hydrogène légèrement acide. Cet hydrogène est celui trouvé dans le groupe -OH qui est situé juste à côté du groupe carbonyle, qui fait partie du carboxyle qui ne réagit pas. Ce type de sels est connu sous le nom de sels acides, car ils ne sont pas totalement neutres.
[TOC]
Structure chimique

Formule
C6H4COOHCOOK = C8H5 Ko4
Nomenclature
- Bifthalate de potassium.
- Phtalate d'acide potassium.
- Hydrogène de potassium.
Propriétés
Densité
1 636 g / ml.
Masse molaire
204.22 g / mol.
Solubilité
Eau et alcool.
Point de fusion
295 ° C avec décomposition.
Aspect
Blanc -to-blanc solide.
Poids spécifique
1,64 gr / cm3.
Étude dérivée de bifthalate de potassium
Des mesures dérichrographiques ont montré que la décomposition du bifthalate de potassium commence entre 190 ° C et 200 ° C, et une préparation non hygroscopique peut être préparée entre 100 ° C et 150 ° C.
La décomposition se déroule en trois étapes, dont la vitesse dépend de la vitesse de l'augmentation de la température: le phtalate dipbotassium est d'abord formé, l'anhydride phtalique et l'eau sont éliminés.
Peut vous servir: chlorure de calcium (CACL2)Les modifications entalpía peuvent également être obtenues à partir de la dérivée, cela produit des informations sur le mécanisme supplémentaire de décomposition thermique et les changements de l'état de l'échantillon.
Utilisations et applications
Ce composé est utilisé dans la chimie analytique dans le titrage ou l'évaluation acide-base comme modèle principal de normalisation dans la préparation de solutions de différents composés.
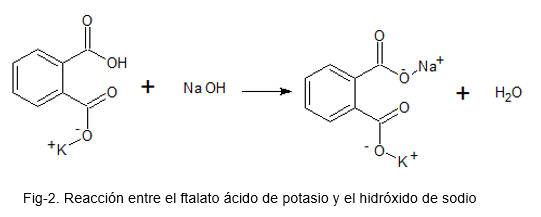
Standardisation d'une base (alcali = naOH)
Lors de la préparation d'une solution de NaOH, il ne peut être garanti que la concentration avec laquelle la solution reste est correcte; En effet.
Une fois la solution préparée, il est nécessaire de savoir exactement quelle concentration il est resté.
Pour cela, une solution est préparée avec du phtalate d'acide potassium, qui est un schéma principal (en raison de sa stabilité élevée); Quelques gouttes d'indicateur acide-base de la fenolphtaléine sont ajoutées et la solution de NaOH comme titre est ajoutée jusqu'à ce qu'une couleur rose soit maintenue présente dans la solution de phtalate d'acide potassium.
Avec les données obtenues, les calculs pertinents sont faits pour trouver la concentration réelle du NaOH.
L'image suivante illustre la réaction chimique entre le phtalate d'acide potassium et l'hydroxyde de sodium.

Comme solution tampon dans la détermination du pH
Une solution tampon ou tampon est celle formée à la fois par l'acide et le sel acide, cela le fait rester dans des conditions de telle sorte que la valeur de pH ne change pas lorsque de petites quantités d'acide ou de base sont ajoutées.
Peut vous servir: Gravimétrie: analyse gravimétrique, méthodes, utilisations et exemplesDes risques
- Exposition aux incendies. Comme pour la plupart des solides organiques, il est possible que le feu à des températures élevées ou par contact avec une source d'allumage puisse se produire.
- La poussière fine dispersée dans l'air à des concentrations suffisantes, et en présence d'une source d'allumage, est un potentiel d'explosion de poussière dangereuse.
- C'est une substance stable à température ambiante et dans des conditions de stockage adéquates. La chaleur et l'humidité excessives doivent être évitées.
- Il peut être incompatible avec de forts oxydants tels que l'acide nitrique.
- La décomposition peut former des oxydes de carbone toxiques.
Concernant la santé
- Par ingestion accidentelle, il peut provoquer des vomissements, de la diarrhée et de l'irritation dans les membranes en raison de leur acidité.
- Par inhalation, il provoque une irritation dans les voies respiratoires et la toux.
- Dans la peau, cela provoque une irritation.
- Aux yeux, cela provoque une irritation, une rougeur et une douleur.
- Il est considéré que ce n'est pas une substance cancérogène, tératogène ou mutagène.
Urgence et premiers soins
- Lavez les yeux avec beaucoup d'eau, enlevez les ralentissements en cas de transport et laissant l'eau traverser les yeux sans être touché avec les mains.
- S'il y avait un contact avec la peau, retirez les costumes et les chaussures, lavez avec beaucoup d'eau et lavez très bien les vêtements avant de revoir.
- En cas d'ingestion, évitez de provoquer des vomissements, l'eau potable.
- En cas d'inhalation, emmenez la personne pour respirer l'air frais; En cas de respiration difficile, alimentez l'oxygène.
- Dans tous les cas, vous demandez une assistance médicale urgente.
- En cas de fuites ou de déversement, récupérez le produit dans un récipient propre et essayez de faire en sorte que la poussière ne se disperse pas.
Il peut vous servir: quels sont les effets négatifs que nous avons avec la solubilité dans l'eau?Mesures de protection personnelle
- Restez en dehors de l'endroit où les boissons, la nourriture et les aliments sont stockés (nourriture pour animaux).
- Utilisez des masques anti-poussière, des gants en néoprène ou en PVC. À l'heure actuelle, les gants en nitrile sont utilisés.
- Portez des vêtements adéquats qui couvrent la majeure partie du corps, y compris des bottes couvertes ou des verres de chaussures et de sécurité.
- La ventilation d'échappement locale est recommandée, avec un système d'extracteur d'air, en tenant compte de la direction du vent prédominant.
- Le produit est miscible dans l'eau, il n'est pas absorbé au sol, il n'est pas bioacumulable ou biodégradable, il ne devrait pas affecter la vie aquatique. Cependant, au moment de la rejeter, cela doit être fait avec l'aide d'un personnel spécialisé: ne pas jeter par drains.
- Conserver dans une zone orange / verte, un lieu sec et ventilé et séparé du matériau incompatible.
Les références
- Merck, (s.f), Merckmillipore.com
- Chang R.,(1992), Chemistry, (quatrième édition), Mexique, McGraw-Hill Inter-American du Mexique.A, de C.V
- Meyer Chemistry Reagents, (S.f), fiche de données de sécurité, bifthalate de potassium, récupéré de, réactifs.com.mx
- Belcher, R.,Erdey, L.,Paulik, F.,Liptay.g.,(Juillet 1960), Potassium Hydrogenophthatefthalate Fire, ScienceDirect, Volume 5, numéro 1, Pages 53-57, org / 10.1016 / 0039-9140 (60) 80205-6

