Structure de benzoate de sodium, propriétés, utilisations et risques
- 2880
- 476
- Louna Baron
Il benzoate de sodium C'est un sel organique dont la formule chimique est C6H5Chemin. Il se produit ou génère par réaction de neutralisation entre l'acide benzoïque et l'hydroxyde de sodium. Le résultat est un solide blanc (image inférieure) dans l'eau et se décompose par chauffage à 120 ºC.
Ce sel peut être trouvé naturellement dans plusieurs fruits et autres parties de légumes, comme: les bleuets, les prunes, les raisins secs, la cannelle, les ongles et les pommes. C'est aussi un métabolite d'algues et de plantes.
 Benzoate de sodium. Source: Chemik10 à Polish Wikipedia [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]
Benzoate de sodium. Source: Chemik10 à Polish Wikipedia [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)] Le benzoate de sodium ne s'accumule pas dans le corps, car il est rapidement combiné avec l'acide aminé de glycine pour former l'acide hippurique, qui est librement excrété dans l'urine.
Ce composé est utilisé avec le conservateur alimentaire, son action étant plus efficace pour un pH acide. Cela est dû à la présence d'acides biologiques qui donnent à la nourriture un pH adapté à l'action du benzoate de sodium; Qu'en tant que tel, il finit par protronler l'acide benzoïque.
Ce sel est également utilisé dans le traitement des troubles métaboliques héréditaires du cycle de l'urée, qui produit l'accumulation d'un métabolite intermédiaire, pour lequel l'enzyme qui le traite est pauvre.
Le programme international de sécurité chimique n'a trouvé aucun effet nocif du benzoate de sodium sur l'homme, pour la consommation entre 647 et 825 mg / kg de masse corporelle.
Cependant, il a été rapporté que le benzoate de sodium peut produire des réactions pseudoallergiques et exacerber les symptômes chez les patients présentant des épisodes fréquents d'urticaire et de l'asthme.
[TOC]
Structure de benzoate de sodium
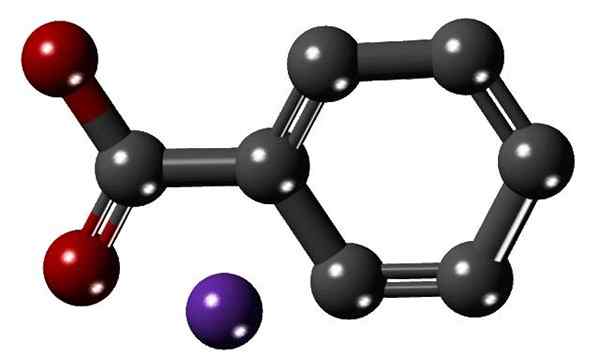
 Structure de benzoate de sodium. Source: Kamil9243 [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]
Structure de benzoate de sodium. Source: Kamil9243 [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] L'image supérieure montre la structure du benzoate de sodium avec un modèle de sphères et de barres. La bague aromatique, avec le groupe carboxylate, peut-on remarquer avec le carboxylate-, lié à lui (celui des sphères rouges); et ce dernier, à son tour, attire l'électrostátiquement vers le na cation+ (sphère violette).
Comme la différence de taille entre les deux ions est grande (comparer l'image), il n'est pas étrange que l'énergie réticulaire des cristaux de benzoate de sodium soit faible. Cela fait que leurs cristaux ont une tendance naturelle à solubiliser dans des solvants polaires ou à subir une série de réactions chimiques.
Peut vous servir: État gazeux: caractéristiques, loi générale, exemplesLe C6H5Roucouler- Vous pouvez accepter deux ponts d'hydrogène de deux molécules d'eau, ce qui favorise son hydratation. Pendant ce temps, le na+ Il se termine également solva par l'eau, surmontant les forces électrostatiques qui le maintiennent avec C6H5Roucouler-.
Ainsi, ce sel se compose de c ions6H5Roucouler- et na+, qui sont disposés de manière ordonnée pour construire des cristaux. Dans la littérature, les informations ne sont pas obtenues concernant sa structure cristalline, il est donc inconnu quel est le type de cellule unitaire pour ce sel.
[TOC]
Propriétés
Noms chimiques
-Benzoate de sodium
-Sel de sodium d'acide benzoïque
-Sobenato
-Antimol.
Description physique
Granules blancs ou poussière cristalline. Poudre cristalline incolore.
Odeur
Toilettes.
Saveur
Doux-amer, astringent et désagréable.
point d'allumage
> 100 ºC.
Auto allumage
> 500 ºC.
Densité
1,50 g / cm3.
Solubilité
-Soluble dans l'ammonium liquide et la pyridine.
-Peu soluble dans l'éthanol: 8,22 g / 100 g à 25 ° C.
-Dans le méthanol, il est plus soluble que dans l'éthanol: 8,22 g / 100 g à 15 ° C.
La stabilité
Il est stable dans les conditions de stockage recommandées. Il peut être sensible à l'humidité, hydrolysant à l'acide benzoïque. Incompatible avec de forts agents oxydants, des alcalis et des acides minéraux.
Décomposition
Lorsqu'il est chauffé à la décomposition à 120 ºC (248 ºF), il émet une fumée d'acre d'oxyde de sodium et d'autres composants qui peuvent être toxiques et cancérigènes.
En décomposant 120 ° C, il empêche de déterminer avec précision ses points d'ébullition et de fusion, les valeurs rapportées de ces paramètres sont des estimations théoriques.
pH
Près de 8, dissous dans l'eau. C'est-à-dire que c'est un sel de base. C'est parce qu'il est hydrolysé pour libérer les ions oh-.
Tension superficielle
72,9 MN / cm à 20 ºC dans une solution de 1 g / L.
La synthèse
L'acide benzoïque impliqué dans la synthèse du benzoate de sodium est principalement produit par trois méthodes:
-Le naphtalène est oxydé avec le pentoxyde de vanadium pour former de l'anhydride ftálic. Ce composé peut sous-boîte pour créer l'acide benzoïque, car dans sa structure avec deux anneaux aromatiques, il semble avoir deux groupes-condensat avec l'autre.
-Le toluène est oxydé à l'acide benzoïque en ajoutant de l'acide nitrique. Dans cette réaction, le groupe "simplement" Metilo oxyde le groupe carboxyle:
C6H5Ch3 => C6H5COOH
-Et enfin, le benzotriclorure est hydrolysé par l'action des acides minéraux, provoquant l'acide benzoïque.
Peut vous servir: Matériaux en céramique: caractéristiques, types, exemplesObtenu de l'acide benzoïque par l'une de ces trois méthodes, puis se dissout dans l'hydroxyde de sodium. Ces composés éprouvent une réaction de neutralisation, produisant du sodium et du benzoate d'eau.
C6H5COOH + NAOH => C6H5Chemin + H2SOIT
La réaction peut également être effectuée avec du carbonate de sodium, bien que ses performances puissent être inférieures à ce que vous souhaitiez.
Applications
Dans la nourriture
Le benzoate de sodium est un agent de conservateur alimentaire, pouvant inhiber ou retarder le processus de fermentation, d'acidification ou de tout processus qui en produit une détérioration. De plus, le benzoate de sodium a une action fongicide.
Ce sel est capable d'éliminer les levures, les bactéries et les champignons présents dans la nourriture. Son action de conservateur est plus efficace pour le pH < 6; es decir, en condiciones ácidas. Por esta razón es usado en conservas y en aliños de ensaladas que contienen vinagre (ácido acético).
Le benzoate de sodium est également utilisé dans la conservation des boissons gazeuses et gazeuses, dans lesquelles l'acide carbonique est présent. Également dans des confitures, riches en acide citrique, et en général, dans les aliments avec des acides présents qui établissent un milieu acide.
De plus, il est utilisé dans l'alimentation avec une concentration de benzoate de sodium de 0,1%. La quantité maximale d'acide benzoïque et de benzoate de sodium utilisé, comme préservatifs dans les aliments, ne dépasse pas 2.000 mg / kg de nourriture.
Traitement médical
Hyperamonémie aiguë
Le phénylacée de sodium et le benzoate de sodium sont utilisés, sous forme de thérapies adjuvantes, dans le traitement de l'hyperamonémie aiguë et une fllusopathie associée chez les patients présentant des altérations du cycle de l'urée.
Ces composés sont classés comme médicaments orphelins. Cette dénomination s'applique aux médicaments qui ne sont pas rentables du point de vue économique.
Schizophrénie
Le benzoate de sodium a été utilisé expérimentalement dans le traitement de la schizophrénie. La partie centrale de l'investigation est le rôle que l'inhibition des enzymes oxydase des acides d-eamino, une activité que le benzoate de sodium rencontre le traitement dans le traitement.
Arginosuccine acide
Le benzoate de sodium est utilisé dans le traitement de l'acide acide de l'arginosuccine, un trouble métabolique héréditaire qui peut provoquer chez les patients une élévation de la concentration d'ammonium, capable d'affecter le système nerveux central.
Peut vous servir: acide benzyique: synthèse, transposition et utilisationsInhibiteur
-Il s'agit d'un inhibiteur de l'enzyme d'Araquidonato 15-lipoxigenasa, une enzyme qui est étudiée par l'industrie pharmaceutique pour être impliquée dans les coronaryopathies.
-Inhibe l'action de l'enzyme de la trihacilglycéride lipase, une enzyme qui agit produisant la libération de glycérol et d'acides gras dans l'intestin grêle, permettant ainsi l'absorption de ces lipides présents dans les aliments.
Peut-être possible l'utilisation du benzoate de sodium pour réguler l'absorption intestinale de lipides tels que les triacylglycérides.
Troubles héréditaires
Le benzoate de sodium est utilisé dans le traitement de plusieurs troubles héréditaires, liés au métabolisme des acides aminés, parmi lesquels sont cités: Traitement de l'hyperargininémie, et le traitement de la carence en enzyme translocase de l'ornitine.
Autres
-Il est utilisé dans des rinçages à base d'alcoolisme et dans le vernis argenté. De plus, il est utilisé dans l'élaboration des composés pyrotechniques, étant responsable du sifflet produit lorsqu'ils sont allumés.
-Il est utilisé comme anticorrosif, qui est l'une des principales exigences de la production de ce sel. Il est également utilisé dans les réfrigérants, l'antigel et d'autres systèmes basés sur l'eau.
-Dans la formulation de plastiques tels que le polypropylène, il est utilisé pour améliorer sa résistance et sa clarté.
-Il sert de stabilisateur dans les salles de bains et les processus photographiques.
Des risques
Le benzoate de sodium est classé par la FDA comme "généralement sûr", à une dose de 0,1% du poids des aliments. Il n'est pas considéré comme irritant pour contacter la peau et les yeux, il peut donc être dit que la toxicité aiguë est faible.
Cependant, le benzoate de sodium peut produire des réactions non immunologiques (pseudoallergie) par contact. Cet effet est rare chez les gens normaux, mais chez les patients présentant des épisodes d'urticarias fréquents ou de symptômes d'asthme, il peut y avoir une augmentation de la fréquence de ces symptômes.
Dans les études réalisées chez le rat et les souris, aucune indication d'une action cancérigène du benzoate de sodium n'a été trouvée.
L'inconvénient de son utilisation en présence d'acide ascorbique, qui pourrait produire du benzène; Composé toxique, indiqué comme cancérogène.
Les références
- Industries nettes. (2019). Production de benzoate de sodium. Récupéré de: science.jank.org
- Wikipédia. (2019). Benzoate de sodium. Récupéré de: dans.Wikipédia.org
- Se publier. (2019). Benzoate de sodium. Récupéré de: pubchem.NCBI.Nim.NIH.Gouvernement
- Hanes t. (2019). Faits sur le benzoate de sodium. Vieilleur. Récupéré de: Livestrong.com
- Livre chimique. (2017). Benzoate de sodium. Récupéré de: Chemicalbook.com
- Piste h. et chou. (2013) JAMA PSICIATRY. 70 (12): 1267 - 1275.
- Organisation mondiale de la santé Genève. (12 avril 2005). Acide benzoïque et benzoate de sodium. [PDF]. Récupéré de: qui.int
- « Avantages malojillo, données nutritionnelles, contre-indications
- Les 16 drogues les plus dangereuses et leurs effets »

