Caractéristiques de l'autophagie, types, fonctions, études
- 2131
- 464
- Jade Duval
La Autophagie Il s'agit d'un système de dégradation intracellulaire qui se produit de manière conservée dans les lysosomes de toutes les cellules eucaryotes (et les vacuoles des levures). Le mot est généralement utilisé pour se référer à la dégradation des composants du cytosol ou des "parties" de la cellule qui sont "obsolètes" ou qui ont cessé de fonctionner correctement.
Le terme autophagie a été inventé en 1963 à l'Université Rockefeller par Duve, qui a également observé et décrit les processus d'endocytose cellulaire. Littéralement, le mot autophagie signifie «se consommer», bien que certains auteurs le décrivent comme un «cannibalisme de voiture».
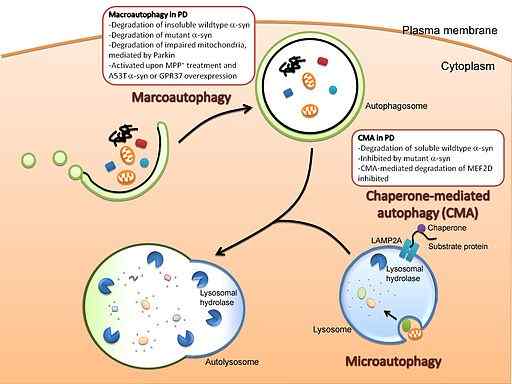
 Représentation graphique du macroautophage et de la microanophagie (Source: Cheung et IP [CC par 3.0 (https: // CreativeCommons.Org / licences / par / 3.0)] via Wikimedia Commons)
Représentation graphique du macroautophage et de la microanophagie (Source: Cheung et IP [CC par 3.0 (https: // CreativeCommons.Org / licences / par / 3.0)] via Wikimedia Commons) Ce système diffère de la dégradation médiée par la dégradation.
Malgré cette phagocytose non sélective, différentes recherches ont montré que l'autophagie a de nombreuses implications physiologiques et pathologiques. Puisqu'il est activé pendant les périodes d'adaptation à la famine, pendant le développement, pour l'élimination des micro-organismes envahisseurs, pendant la mort cellulaire programmée, pour l'élimination des tumeurs, la présentation des antigènes, etc.
[TOC]
Caractéristiques
L'autophagie, comme mentionné, est un processus médié par un organlier cytoplasmique connue sous le nom de lysosome.
Le processus «autophagie» commence par l'encapsulation de l'organelle qui sera dégradée par une double membrane, formant un corps membraneux connu sous le nom d'autophagosome. La membrane autophagosome fond, plus tard, avec la membrane lysosomale ou avec un endosome tardif.
Chacune de ces étapes entre l'enlèvement, la dégradation et la libération des acides aminés ou d'autres composants pour le recyclage exercent différentes fonctions dans différents contextes cellulaires, ce qui fait de l'autophagie un système hautement multifonctionnel.
L'autophagie est un processus assez contrôlé, car seules les composants cellulaires marqués sont dirigés vers ce chemin de dégradation et le marquage se produit généralement pendant les processus de remodelage cellulaire.
Par exemple, lorsqu'une cellule hépatique établit une réponse de détoxification en réponse à des médicaments solubles en graisse, son réticulum endoplasmique lisse prolifère considérablement et lorsque le stimulus généré par le médicament diminue, un réticulum endoplasmique lisse est retiré de l'espace cytosolique par autophagie.
Induction de l'autophagie
L'un des événements qui déclenche le plus souvent les processus autophagiques est la famine.
Peut vous servir: Exocytose: processus, types, fonctions et exemplesSelon l'organisme considéré, différents types de nutriments essentiels peuvent déclencher ce système de "recyclage". Chez les levures, par exemple, bien que le manque de carbone de certains acides aminés et acides nucléiques puisse induire l'autophagie, le manque d'azote est le stimulus le plus efficace, qui est également valable pour les cellules végétales.
Bien qu'il n'ait pas été complètement compris, les cellules ont des «capteurs» spéciaux pour déterminer quand un nutriment ou un acide aminé essentiel est dans des conditions très faibles, et ainsi déclencher l'ensemble du processus de recyclage à travers les lysosomes.
Chez les mammifères, certaines hormones participent à la régulation (positive ou négative) de l'autophagie dans les cellules appartenant à certains organes, tels que l'insuline, certains facteurs de croissance ou interleukins, etc.
Gars
Il existe trois principaux types d'autophagie chez les eucaryotes: la macroautophagie, la microanophagie et l'autophagie médiées par des chaperons. Sauf spécifié, le terme autophagie fait référence au macroautophage.
Bien que les trois types d'autophagie soient morphologiquement différents, tous se terminent dans le transport des substances vers les lysosomes pour leur dégradation et leur recyclage.
Macroautophage
Ceci est un type d'autophagie qui dépend de la formation de Novo des vésicules phagocytaires appelées autophagosomes. La formation de ces vésicules est indépendante de la formation de "jaunes" de la membrane, car ils sont formés par l'expansion.
Chez les levures, la formation d'autophagosomes commence dans un endroit particulier connu sous le nom de PAS, tandis que chez les mammifères, de nombreux sites de cytosol différents se produisent, probablement liés au réticulum endoplasmique à travers des structures appelées "omégasomes".
La taille des autophagosomes est très variable et dépend de l'organisme et du type ou de la molécule organulum qui est phagocyte. Peut varier de 0.4-0.9 μm de diamètre chez les levures jusqu'à 0.5-1.5 μm chez les mammifères.
Quand les membranes autophagosomes et lysosomes mel. Cet organite est alors connu sous le nom d'autolisosomes.
Pour certains auteurs, le macroautophage peut être sous-classé, à son tour, dans l'autophagie induite et l'autophagie basale. Le macroautophage induit est utilisé pour produire des acides aminés après une période prolongée de famine.
Macroautophage basal.
Peut vous servir: radeaux lipidiques: caractéristiques, types, fonctionsMicroanophagie
Ce type d'autophagie fait référence au processus dans lequel le contenu cytoplasmique est introduit dans le lysosome par des invaginations qui se produisent dans la membrane de ladite organelle.
Une fois introduits dans le lysosome, les vésicules produites par ces invaginations flottent librement dans la lumière jusqu'à ce qu'elles soient répertoriées et que leur contenu soit libéré et dégradé par des enzymes spécifiques.
Selfophagie médiée par le chaperon
Ce type d'autophagie n'a été signalé que pour les cellules de mammifères. Contrairement à la macroautophagie et à la microanophagie, où certaines parties cytosoliques ne sont pas spécifiques.
Certains chercheurs ont déterminé que ce motif pentapéptide est lié à la séquence de Kferq et qu'il représente plus de 30% des protéines cytosoliques.
Il est appelé «médiatisé par chaperonas» car les protéines chaperon sont responsables du maintien de cette raison préservée pour faciliter leur reconnaissance et éviter le pliage de la protéine dessus.
Les protéines avec cette étiquette sont transloquées en lumière lysosomale et il y a une dégradation. De nombreux substrats de dégradation sont des enzymes glycolytiques, des facteurs de transcription et leurs inhibiteurs, des protéines ou des lipides de l'union de calcium, des sous-unités protéosomes et certaines protéines impliquées dans le trafic vésiculaire.
Ainsi que les deux autres types d'autophagie, l'autophagie médiée par chaperon.
Les fonctions
L'une des principales fonctions de l'autophage.
Grâce à l'observation des microphotographies électroniques des lysosomes dans les cellules mammifères, la présence de peroxysomes et de mitochondries a été détectée dans ces.
Dans une cellule hépatique, par exemple, la durée de vie moyenne d'une mitochondrie est de 10 jours, après quoi cet organelle est phagocyté par les lysosomes, où il est dégradé et ses composants sont recyclés à différentes fins métaboliques.
Sous une faible concentration de substances nutritionnelles, les cellules peuvent déclencher la formation d'autophagosomes pour «capturer sélectivement» des parties du cytosol, ainsi que les métabolites digérés dans ces autophagosomes peuvent aider les cellules à survivre lorsque les conditions externes sont limitantes du point de vue nutritionnelle.
Peut vous servir: érythropoïèse: étapes et ses caractéristiques, régulation, stimulantsFonctions de la santé et du développement
L'autophagie a des fonctions importantes dans la restructuration cellulaire dans le processus de différenciation, car il participe à la suppression des parties cytosoliques qui ne sont pas nécessaires à des moments précis.
Il a également des implications importantes dans la santé des cellules, car elle fait partie des mécanismes de défense contre les virus et les bactéries envahissantes.
Études Yoshinori Ohsumi
Yoshinori Ohsumi, chercheur japonais en 2016 avec le prix Nobel de physiologie et de la médecine, a décrit les mécanismes moléculaires de l'auto-défense chez les levures tout en étudiant la destination métabolique de nombreuses protéines et vacuoles de ces organismes unicellulaires.
Dans ses œuvres, Ohsumi a non seulement identifié les protéines et les voies impliquées dans le processus, mais a également démontré comment l'itinéraire d'autophagie est régulé grâce à l'action des protéines capables de «censurer» différents états métaboliques.
Son travail a commencé avec des observations microscopiques précises lors d'événements de dégradation intense. Les vacuolas sont considérés comme les sites de stockage des "ordures" et les déchets cellulaires des levures.
En observant des levures avec des génotypes mutants défectueux pour des gènes différents ou hypothétiquement liés à l'autophagie (appelés gènes ATG), Ce chercheur et ses collaborateurs ont réussi à décrire le système de levure autophagique au niveau génétique.
Par la suite, ce groupe de chercheurs a déterminé les principales caractéristiques génétiques des protéines codées par ces gènes et a apporté des contributions significatives sur leur interaction et la formation des complexes responsables du début et de l'exécution de la phase auto-phase dans les levures.
Grâce aux œuvres de Yoshinori Ohsumi, nous comprenons aujourd'hui mieux les aspects moléculaires de l'autophagie, ainsi que ses implications importantes dans le bon fonctionnement des cellules et des organes qui nous composent de nous.
Les références
- Alberts, B., Johnson, un., Lewis, J., Morgan, D., Raff, m., Roberts, k., & Walter, P. (2015). Biologie de la cellule moléculaire (6e Ed.). New York: Garland Science.
- Klionsky, D. J., & EMR, S. D. (2000). Autophagie comme voie régulée de dégradation cellulaire. Science, 290, 1717-1721.
- Mizushima, n. (2007). Autophagie: processus et fonction. Gènes et développement, vingt-et-un, 2861-2873.
- Mizushima, Noboru et Komatsu, M. (2011). Autoroute: renouvellement des cellules et des tissus. Cellule, 147, 728-741.
- Rabinowitz, J. D., & Blanc, et. (2010). Autophagie et métabolisme. Science, 330, 1344-1348.
- « Caractéristiques de maîtrise, habitat, reproduction, contrôle biologique
- Caractéristiques de la tarentule, habitat, espèces, comportement »

