Aldéhydes

- 2641
- 815
- Paul Dumas
Quels sont les aldéhydes?
Les aldéhydes Ce sont des composés organiques qui ont une formule générale rcho. R représente une chaîne aliphatique ou aromatique; C carbone; Ou l'oxygène et l'hydrogène H. Ils se caractérisent par la possession d'un groupe carbonyle, comme les cétones et les acides carboxyliques, donc les aldéhydes sont également appelés composés carbonyle.
Le groupe carbonyle donne à l'aldéhyde bon nombre de ses propriétés. Ce sont des composés facilement oxydés et très réactifs aux ajouts nucléophiles. La double liaison du groupe carbonyle (C = O) présente deux atomes qui ont des différences dans leur avidité par les électrons (électronégativité).
L'oxygène attire les électrons plus fortement que le carbone, donc le nuage électronique se déplace vers lui en faisant la double liaison entre le carbone et l'oxygène de nature polaire, avec un moment dipolaire important. Cela fait les aldéhydos.
En d'autres termes, les aldéhydos sont un type de composés organiques résultant de l'oxydation de certains alcools.
Structure chimique des aldéhydos
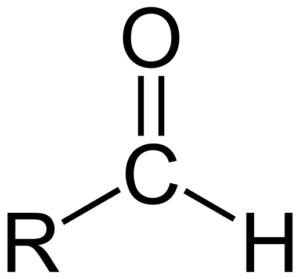 Structure chimique des aldéhydos
Structure chimique des aldéhydos Les aldéhydos sont constitués d'un carbonyle (c = o) auquel un atome d'hydrogène est directement lié. Cela le différencie des autres composés organiques, comme les cétones (R2C = O) et les acides carboxyliques (RCOOH).
L'image supérieure montre la structure moléculaire autour du -cho, groupe de groupe. Le groupe formile est plat car le carbone et l'oxygène ont une hybridation SP2. Cette planarité le rend sensible à l'attaque des espèces nucléophiles, et par conséquent, il est facilement oxydé.
Que signifie une telle oxydation? À la formation d'un lien avec tout autre atome plus électronégatif que le carbone; Et dans le cas des aldéhydos, c'est un oxygène. Ainsi, l'aldéhyde oxyde un acide carboxylique, -coh. Et si l'aldéhyde était réduit? Un alcool primaire serait formé à la place, Roh.
Les aldéhydos ne se produisent que des alcools primaires: ceux où le groupe OH est à la fin d'une chaîne. De même, le groupe formil toujours Il est à la fin d'une chaîne ou de se démarquer de lui ou de l'anneau en tant que substituant (s'il existe d'autres groupes plus importants, tels que -cooh).
Propriétés physiques et chimiques des aldéhydes
Étant des composés polaires, leurs points de fusion sont supérieurs à ceux des composés non polaires. Les molécules d'aldéhydos ne sont pas en mesure de se lier intermoléculairement par des ponts d'hydrogène, pour avoir seulement des atomes de carbone unis aux atomes d'hydrogène.
En raison de ce qui précède, les aldéhydes ont des points d'ébullition plus bas que les alcools et les acides carboxyliques.
Points de fusion
Formaldéhyde -92; Acétaldéhyde -121; Propionaldéhyde -81; n- butiraldéhyde -99; N -Valeeraldehyde -91; Caproaldéhyde -; Heptaldéhyde - 42; Phénylacétaldéhyde -; Benzaldéhyde -26.
Points d'ébullition
Formaldéhyde -21; Acétaldéhyde 20; Propional de Hyd 49; N-Butiraldehido 76; N-Valeeraldehyde 103; Caproaldéhyde 131; Heptaldéhyde 155; Phénylacétaldéhyde 194; Benzaldéhyde 178.
Peut vous servir: propriétés spécifiques de la matière: ce que sont et des exemplesSolubilité dans l'eau exprimée en g / 100 g de h2SOIT
Formaldéhyde, très soluble; acétaldéhyde, infini; Propionaldéhyde, 16; N-Butiraldéhyde, 7; N-Valealdéhyde, légèrement soluble; Caproaldéhyde, légèrement soluble; Phénylacétaldéhyde légèrement soluble; Benzaldéhyde, 0,3.
Les points d'ébullition des aldéhydos ont tendance à augmenter directement avec le poids moléculaire. Au contraire, il y a une tendance à réduire la solubilité des aldéhydes dans l'eau à mesure que leur poids moléculaire augmente. Cela se reflète dans les constantes physiques des aldéhydes nouvellement mentionnés.
Réactivité des aldéhydos
Réaction d'oxydation
Les aldéhydes peuvent oxyder l'acide carboxylique correspondant en présence de l'un de ces composés: AG (NH3)2, Kmno4 d'accord2Croisement2SOIT7.
Réduction des alcools
Ils peuvent s'hydrogène à l'aide de catalyseurs de nickel, de platine ou de paladium. Ainsi, c = o est transformé en c-oh.
Réduction des hydrocarbures
En présence de Zn (Hg), HCl concentré ou en NH2NH2 Les aldéhydos perdent le groupe carbonyle et deviennent des hydrocarbures.
Addition nucléophile
Il y a plusieurs composés qui sont ajoutés au groupe carbonyle, parmi lesquels sont les suivants: Grignard, réactifs de cyanure, dérivés d'ammoniac et alcools.
Nomenclature des aldéhydos
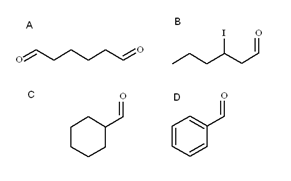 Quatre aldéhydes. Source: Gabriel Bolívar
Quatre aldéhydes. Source: Gabriel Bolívar Dans l'image supérieure, quatre aldéhydos sont illustrés. Comment sont-ils nommés?
Puisqu'ils sont des alcools primaires rouillés, le nom de l'alcool est modifié la terminaison -ol par -al. Ainsi, le méthanol (choisissez3Oh) si oxydé à cho3Cho est appelé métanal (formaldéhyde); Ch3Ch2Cho etanal (acétaldéhyde); Ch3Ch2Ch2CHO PROPANAL ET CHO3Ch2Ch2Ch2Butanal Cho.
Tous les aldéhydos nouvellement nommés ont le groupe -cho à la fin de la chaîne. Quand c'est aux deux extrémités, comme dans A, à la fin - le préfixe DI lui est ajouté-. Comme six carbones (compter ceux des deux groupes de formyles), il dérive du 1-hexanol et son nom est donc: hexanecadran.
Lorsqu'il y a un substituant, comme un radical alquilique, un double ou un triple lien ou un halogène, les carbones de la chaîne principale sont répertoriés en donnant le numéro 1. Ainsi, l'aldéhyde B est appelé: 3-iodhexanal.
Cependant, dans les aldéhydes C et D, le groupe -cho n'a aucune priorité pour identifier ces composés d'autrui. C est un cycloalcano, tandis que d un benzène, tous deux avec l'un de ses h remplacés par un groupe formil.
En eux, comme la structure principale est cyclique, le groupe formil est nommé carbaldéhyde. Ainsi, C est le cyclohexanocbaldéhyde et le benzénocarbaldéhyde (mieux connu sous le nom de benzaldéhyde).
Utilisations d'aldéhydos
Il y a des aldéhydes dans la nature capable de conférer des saveurs agréables, tel est le cas du cannamaldéhyde, responsable de la saveur caractéristique de la cannelle. C'est pourquoi ils sont généralement utilisés comme arômes artificiels dans de nombreux produits, comme des bonbons ou de la nourriture.
Formaldéhyde
Le formaldéhyde est l'aldéhyde qui se produit industriellement en plus grande quantité. Le formaldéhyde obtenu par l'oxydation du méthanol est utilisé dans une solution de gaz à 37% dans l'eau, sous le nom de formol. Ceci est utilisé dans le bronzage des peaux et dans la conservation et l'embaumement des cadavres.
Peut vous servir: acétate de sodium: structure, propriétés, synthèse, utilisationsLe formaldéhyde est également utilisé comme germicide, fongicide et insecticide pour les plantes et les légumes. Cependant, sa plus grande utilité est la contribution à la production de matériaux polymères. Le plastique appelé bakelita est synthétisé par la réaction entre le formaldéhyde et le phénol.
Bakelita
Bakelita est un excellent polymère de structure dimensionnelle dure utilisé dans de nombreux ustensiles domestiques, tels que des pots de pots, de casseroles, de cafetières, de couteaux, etc.
Les polymères similaires à Bakelita sont fabriqués à partir de formaldéhyde en combinaison avec des composés d'urée et de mélamine. Ces polymères sont utilisés non seulement comme plastiques, mais sont également utilisés comme bâtons adhésifs et matériaux de revêtement.
Contre-plaqué
Le contreplaqué est le nom commercial d'un matériau formé par de fines feuilles de bois, rejoints par des polymères produits à partir du formaldéhyde. Les marques formiques et Melmac sont fabriquées avec la participation de ce. Le Formic est un matériau plastique utilisé dans le revêtement de meubles.
Le plastique MMLMAC est utilisé dans l'élaboration des assiettes, des verres, des tasses, etc. Le formaldéhyde est une matière première pour la synthèse du composé de méthylène-difenil-diisocianate (MDI), précurseur du polyuréthane.
Polyuréthane
Le polyuréthane est utilisé comme isolant dans les réfrigérateurs et les congélateurs, rembourré pour les meubles, les matelas, les revêtements, les adhésifs, les semelles, etc.
Butiraldéhyde
Le butiraldéhyde est le principal précurseur de la synthèse du 2-éthylhexanol, qui est utilisé comme plastifiant. Il a un arôme de pomme agréable qui permet à son utilisation dans la nourriture comme arôme.
Il est également utilisé pour les accélérateurs en caoutchouc. Il intervient en tant que réactif intermédiaire dans la fabrication de solvants.
Acétaldéhyde
L'acétaldéhyde a été utilisé dans la production d'acide acétique. Mais cette fonction de l'acétaldéhyde a diminué d'importance, car elle a été déplacée par le processus de carbonilation du méthanol.
La synthèse
Les autres aldéhydes sont des précurseurs d'oxoalcools, qui sont utilisés dans la production de détergents. Les oxoalcoals so-appelés sont préparés en ajoutant du carbone et du monoxyde d'hydrogène à une oléfine pour obtenir un aldéhyde. Et enfin l'aldéhyde est l'hydrogène pour obtenir de l'alcool.
Certains aldéhydos sont utilisés dans la fabrication de parfums, comme le Chanel n ° 5. De nombreux aldéhydes naturels ont des odeurs agréables, par exemple: l'heptanal a l'odeur de l'herbe verte; l'octanal, odeur d'orange; L'odeur non-anale des roses et de la citron, odeur de Lima.
Exemples d'aldéhydes
Glutaraldéhyde
 Glutaraldéhyde. Source: par Jynto [CC0], de Wikimedia Commons
Glutaraldéhyde. Source: par Jynto [CC0], de Wikimedia Commons Le glutaraldéhyde présente dans sa structure deux groupes de formacles aux deux extrémités.
Commercialisé sous le nom de Cidex ou Glutararal, il est utilisé comme désinfectant pour stériliser les instruments chirurgicaux. Il est utilisé dans le traitement des verrues sur les pieds, en appliquant un liquide.
Il est également utilisé comme agent de fixation de tissu dans les laboratoires d'histologie et de pathologie.
Il peut vous servir: sulfate de cuivre (CUSO4): structure, propriétés, obtention, utilisationsBenzaldéhyde
C'est l'aldéhyde aromatique le plus simple, qui est formé par un anneau de benzène où un groupe formil est lié.
Il se trouve dans l'huile d'amande, d'où son odeur caractéristique qui permet son utilisation comme arôme alimentaire. De plus, il est utilisé dans la synthèse de composés organiques liés à la fabrication de médicaments et d'élaboration des plastiques.
Glycéraldéhyde
C'est un aldotriosa, un sucre constitué de trois atomes de carbone. Il présente deux isomères appelés énantiomères D et L. Le glycéraldéhyde est le premier monosaccharide obtenu en photosynthèse pendant la phase sombre (cycle Calvin).
Glycéraldéhyde-3-phosphate
 Glycéraldéhyde. Source: Jynto et Ben Mills
Glycéraldéhyde. Source: Jynto et Ben Mills Dans l'image supérieure, la structure du glycéraldéhyde-3-phosphate est illustrée. Les sphères rouges à côté du jaune correspondent au groupe phosphate, tandis que le noir au squelette de carbone. La sphère rouge liée à la Blanca est le groupe OH, mais lorsque la sphère noire est liée et ce dernier à celle blanche, alors c'est le groupe CHO.
Le glycéraldéhyde-3-phosphate intervient dans la glycolyse, un processus métabolique dans lequel le glucose est dégradé en acide pyruvique avec la production d'ATP, un réservoir d'énergie des êtres vivants des êtres vivants. En plus de la production de NADH, un agent réducteur biologique.
Dans la glycolyse glycoléraldéhyde-3-phosphate et le phosphate dihydroacétone sont causés par le d-fruce-6-6-biphary-fosphate.
Le glycéraldéhyde-3-phosphate intervient dans le processus métabolique connu sous le nom de cycle du pentose. En cela, le NADPH est généré, un réducteur biologique important.
11-cis -retinal
 11-cis -retinal
11-cis -retinal Le β-carotène est un pigment naturel présent dans plusieurs légumes, en particulier dans la carotte. Ressentez une rupture oxydative dans le foie, se transformant ainsi dans l'alcool rétinol ou la vitamine A. L'oxydation de la vitamine A et l'isomérisation ultérieure de l'une de ses doubles liaisons forment l'aldéhyde 11-cis-rétinien.
Phosphate pyridoxal (vitamine B6)
 Phosphate pyridoxal ou vitamine B6. Source: Jynto et Ben Mills.
Phosphate pyridoxal ou vitamine B6. Source: Jynto et Ben Mills. C'est un groupe prothétique attaché à plusieurs enzymes, qui est la forme active de la vitamine B6 et participe au processus de synthèse du neurotransmetteur inhibiteur GABA.
Où est le groupe formil dans sa structure? Notez que cela diffère du reste des groupes liés à l'anneau aromatique.
Salicilaldéhyde
Il s'agit d'une matière première pour la synthèse de l'acide acétylsalicylique, de la médecine analgésique et antipyrétique connue sous le nom d'aspirine.
Les références
- Robert C. Neuman, Jr. Chapitre 13, Composés carbonyle: cétones, aldéhydes, acides carboxyliques. [PDF]. Tiré de: Chem.Ucr.Édu
- Germán Fernández. (14 septembre 2009). Nomenclature des aldéhydos. Tiré de: Chemicicaorganica.filet
- T.W. Graham Salomons, Craight B. Fryhle. Chimie organique. (Dixième édition, p 729-731) Wiley Plus.
- Jerry March et William H. Brun. (31 décembre 2015). Aldéhyde. Tiré de: Britannica.com
- Wikipédia. (2018). Aldéhydes. Pris de: https: // dans.Wikipédia.org / wiki / aldéhyde
- Morrison, R. T. Et Boyd, R. N. (1990). Camimie organique cinquième édition. Éditorial addison-wesley iberoamericana.
- Carey, F. POUR. (2006). Sixième édition en chimie organique. Éditorial de Mc Graw Hill.
- Mathews, ch. K., Van Holde, K. ET. Et Ather, k. g. (2002). Biochimie. Troisième édition. Éditorial Pearson Adisson Wesley.

