Agent de réduction du concept, les exemples les plus forts

- 3064
- 219
- Jade Duval
UN agent réducteur C'est une substance qui remplit la fonction de réduire un agent oxydant dans une réaction de réduction de l'oxyde. Les agents réducteurs sont des donneurs d'électrons par nature, généralement des substances qui sont à leurs niveaux d'oxydation les plus bas et avec une grande quantité d'électrons.
Il y a une réaction chimique dans laquelle les états d'oxydation des atomes varient. Ces réactions impliquent un processus de réduction et d'oxydation complémentaire. Dans ces réactions, un ou plusieurs électrons d'une molécule, atome ou ion sont transférés vers une autre molécule, atome ou ion. Cela implique la production d'une réaction de réduction d'oxyde.

Pendant le processus de réduction de l'oxyde, cet élément ou composé qui perd (ou Dona) son électron (ou électrons) est appelé agent réducteur, contrastant avec cet agent oxydant qui est le récepteur d'électrons. On dit ensuite que la réduction des agents réduit l'agent oxydant et que l'agent oxydant oxyde l'agent réducteur.
Les agents réducteurs les plus ou les plus forts sont ceux qui ont la plus grande radio atomique; c'est-à-dire qu'ils ont une plus grande distance de leur noyau aux électrons qui entourent le même.
Les agents réducteurs sont généralement des ions métalliques ou négatifs. Parmi les agents réducteurs courants figurent l'acide ascorbique, le soufre, l'hydrogène, le fer, le lithium, le magnésium, le manganèse, le potassium, le sodium, la vitamine C, le zinc et même l'extrait de carottes.
[TOC]
Que réduisent les agents?
Comme déjà dit, la réduction des agents est responsable de la diminution d'un agent oxydant lorsqu'une réaction de réduction de l'oxyde se produit.
Une réaction simple et typique de la réaction de réduction de l'oxyde est celle de la respiration cellulaire aérobie:
Peut vous servir: hydrure en aluminium (ALH3): structure, propriétés, utilisationsC6H12SOIT6(s) + 6o2(g) → 6CO2(g) + 6H2Ou (l)
Dans ce cas, où le glucose (c6H12SOIT6) réagit avec l'oxygène (ou2), le glucose se comporte comme l'agent réducteur pour donner des électrons à l'oxygène - c'est-à-dire qu'il est oxydé - et l'oxygène devient un agent oxydant.
En chimie organique, les meilleurs agents réducteurs sont considérés comme des réactifs qui fournissent de l'hydrogène (H2) à la réaction. Dans ce domaine de chimie, la réaction de réduction se réfère à l'ajout d'hydrogène à une molécule, bien que la définition précédente (réactions de réduction de l'oxyde s'applique également.
Facteurs qui déterminent la force d'un agent réducteur
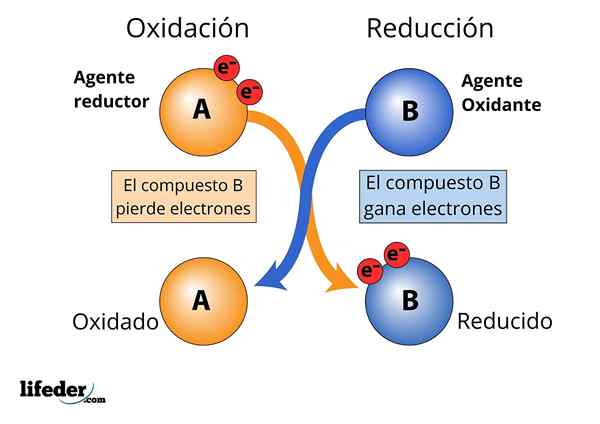 Agent oxydant et réducteur, la perte et le gain d'électrons sont observés
Agent oxydant et réducteur, la perte et le gain d'électrons sont observés Pour qu'une substance soit considérée comme "forte".
Pour cela, il existe un certain nombre de facteurs qui doivent être pris en compte pour reconnaître la force qu'un agent réducteur peut avoir: l'électronégativité, le rayon atomique, l'énergie d'ionisation et le potentiel de réduction.
Électronégativité
L'électronégativité est la propriété qui décrit la tendance d'un atome d'attirer quelques électrons unis vers lui-même. Plus l'électronégativité plus élevée, plus la force d'attraction exercée par l'atome autour des électrons environnants.
Dans le tableau périodique, l'électronégativité augmente de gauche à droite, donc les métaux alcalins sont les éléments les moins électronégatifs.
Radio atomique
C'est la propriété qui mesure la quantité d'atomes. Il se réfère à la distance typique ou moyenne du centre d'un noyau atomique à la frontière du nuage électronique qui l'entoure.
Peut vous servir: nitrites: propriétés, structure, nomenclature, formationCette propriété n'est pas précise - et en outre, plusieurs forces électromagnétiques sont impliquées dans sa définition - mais il est connu que cette valeur diminue de gauche à droite dans le tableau périodique, et augmente de haut en bas. C'est pourquoi les métaux alcalins, en particulier le césium, sont considérés comme une plus grande radio atomique.
Énergie d'ionisation
Cette propriété est définie comme l'énergie nécessaire pour éliminer l'électron moins uni d'un atome (l'électron de valence) pour former un cation.
On dit que plus les électrons sont proches du noyau de l'atome entourant, plus l'énergie d'ionisation de l'atome est grande.
L'énergie d'ionisation augmente de la gauche de la droite et du bas en haut dans le tableau périodique. Encore une fois, les métaux (en particulier alcalins) ont moins d'énergie d'ionisation.
Potentiel de réduction
C'est la mesure de la tendance d'une espèce chimique à obtenir des électrons et, par conséquent, à réduire. Chaque espèce a un potentiel de réduction intrinsèque: plus le potentiel est grand, plus l'affinité avec des électrons et aussi sa capacité à être réduite.
Les agents réducteurs sont ces substances ayant moins de potentiel de réduction, en raison de leur petite affinité avec les électrons.
Agents réducteurs plus forts
Avec les facteurs décrits ci-dessus, on peut conclure que pour trouver un agent réducteur «fort», une atome ou une molécule à faible électronégativité, un rayon atomique élevé et une faible énergie d'ionisation est souhaité.
Comme déjà mentionné, les métaux alcalins présentent ces caractéristiques et sont considérés comme les agents réducteurs les plus forts.
Peut vous servir: hydrocarbures aliphatiques: propriétés, nomenclature, réactions, typesD'un autre côté, le lithium (LI) est considéré4 Il est considéré comme l'agent réducteur le plus fort de tous, pour contenir ceci et les autres caractéristiques souhaitées.
Exemples de réactions avec la réduction des agents
Il existe de nombreux cas de réduction de l'oxyde dans la vie quotidienne. Vous trouverez ci-dessous les plus représentatifs:
Exemple 1
La réaction de combustion de l'octane (la composante principale de l'essence):
2 c8H18(l) + 25o2 → 16co2(g) + 18h2O (g)
Vous pouvez voir comment octane (réduction de l'agent) Dona Oxygen Electrons (agent oxydant), formant du dioxyde de carbone et de l'eau en grande quantité.
Exemple 2
L'hydrolyse du glucose est un autre exemple utile d'une réduction courante:
C6H12SOIT6 + 2adp + 2p + 2nad+ → 2ch3NOIX DE COCO2H + 2ATP + 2NADH
Dans cette réaction, les molécules NAD (un récepteur d'électrons et l'agent oxydant dans cette réaction) prennent des électrons de glucose (agent réducteur).
Exemple 3
Enfin, dans la réaction de l'oxyde ferrique
Foi2SOIT3(s) + 2al (s) →2SOIT3(s) + 2fe (l)
L'agent réducteur est en aluminium, tandis que l'agent oxydant est le fer.
Les références
- Wikipédia. (s.F.). Wikipédia. Obtenu à partir de.Wikipédia.org
- BBC. (s.F.). BBC.co.ROYAUME-UNI. Obtenu à partir de la BBC.co.ROYAUME-UNI
- Pearson, D. (s.F.). CHIMISTER BOOLISTexts. Obtenu à partir de Chem.Bibliothèque.org
- Recherche, b. (s.F.). Bodner Research Web. Obtenu de Murmed.Chem.Purger.Édu
- Peter Atkins, L. J. (2012). Principes chimiques: la quête de la perspicacité.
- « Propriétés de Cassia Angustifolia, préparation, contre-indications
- Caractéristiques de projection azimutale, types, avantages, inconvénients »

