Agar MacConkey
- 2225
- 123
- Raphaël Meyer
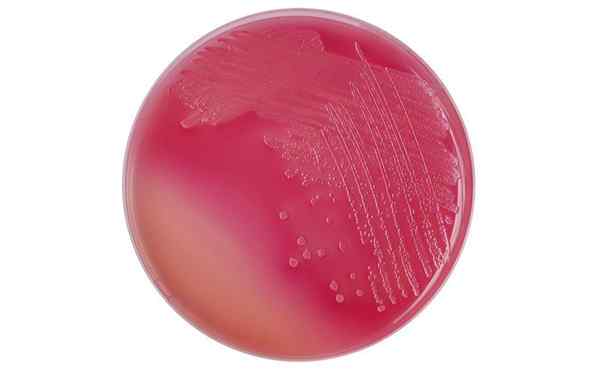
 Colonies d'Escherichia coli sur une plaque d'agar MacConkey. Avec licence
Colonies d'Escherichia coli sur une plaque d'agar MacConkey. Avec licence Quelle est l'agar MacConkey?
Il Agar MacConkey C'est un support de culture solide. sélectif et différentiel, ce qui permet un isolement exclusif de bacilles négatifs à Gram. Pour cette raison, il permet de distinguer les bacilles de fermentation et de non-fermentation du lactose. C'est l'un des médias culturels les plus utilisés dans un laboratoire de microbiologie.
Ce milieu est principalement utilisé pour isoler les bacilles négatifs en gramme appartenant à la famille Enterobacteriaceae, y compris les espèces opportunistes et entéropathogènes.
Il peut également être utilisé pour isoler d'autres bacilles entériques qui habitent le tractus gastro-intestinal, mais qui n'appartiennent pas aux entérobactéries, comme Spere SP, Pesiomonas SP, entre autres.
Enfin, il peut isoler d'autres bacilles de glucose non fermentatifs trouvés dans l'environnement, l'eau ou les sols, mais parfois ils peuvent être des agents pathogènes opportunistes, tels que Pseudomonas sp, Acinetobacter SP, SP, Chromobacterium vioaceum, Stenotrophomonas maltophilia, entre autres.
Base
Agar MacConkey
Le fondement de ce support peut être expliqué à travers la description de ses composants, car chacun a un but qui détermine une propriété.
Sels biliaires et verre violet
En ce sens, MacConkey Agar a une composition complexe. Tout d'abord, il contient des sels biliaires et du verre violet.
Ces éléments sont responsables de l'inhibition de la croissance des bactéries positives à Gram et des bacilles à gramme exigeant. À son tour, il favorise le développement de bacilles négatifs à Gram qui ne sont pas affectés par ces substances. C'est donc un support sélectif.
On dit qu'il est légèrement sélectif par rapport à d'autres milieux qui inhibent également la croissance des bactéries positives à Gram et également de la plupart des bactéries négatives.
Peptonas, polypes et lactose
Il contient des substances qui fournissent les nutriments nécessaires aux micro-organismes qui se développent dans ce milieu, comme les peptones, les polypes et le lactose.
Le lactose est le point clé pour que le milieu soit différentiel, car les micro-organismes qui ont la capacité de fermenter le lactose développeront de fortes colonies roses.
Peut vous servir: Dryopithecus: découverte, caractéristiques, crâne, nourritureCertaines bactéries peuvent fermenter le lactose lentement ou faiblement, développant des colonies roses pâles et rester positives du lactose.
Ceux qui ne ferment pas le lactose utilisent des peptones comme source d'énergie, produisant de l'ammoniac, alcalissant le milieu. Par conséquent, les colonies qui proviennent sont incolores ou transparentes.
Indicateur de pH
Le changement de couleur est réalisé grâce à un autre composé essentiel que MacConkey est d'accord. Ce composé est l'indicateur de pH, qui dans ce cas est le rouge neutre.
La fermentation du lactose génère une production d'acide mixte. Ils acidifient le milieu à un pH inférieur à 6,8.
Cela fait vire l'indicateur de pH vers un rose intense. L'intensité des couleurs peut varier en fonction du pH final.
Eau distillée, chlorure de sodium et gélose
D'un autre côté, il contient de l'eau distillée et du chlorure de sodium qui donnent l'hydratation et l'équilibre osmotique à l'environnement. Enfin, le milieu contient de l'agar, qui est la base qui fournit la cohérence du milieu solide.
L'agar MacConkey préparée doit avoir un pH final ajusté à 7,1 ± 0,2.
préparation
Pour un litre d'agar MacConkey, 50 gr du milieu déshydraté doivent être pondérés, puis il est placé dans une solution et se dissout dans un litre d'eau distillée. Après 10 minutes de repos, il est chauffé en se mélangeant constamment jusqu'à ce qu'il bouillonne pendant 1 minute.
Ensuite, le fixola est placé dans l'autoclave et stérilisé à 121 ° C pendant 20 minutes. Temps culminé, il est retiré de l'autoclave et laissé refroidir jusqu'à ce qu'une température de 45 ° C soit atteinte, pour servir plus tard dans le Petri stérile.
Peut vous servir: tactismeLaisser solidifier et économiser dans un support inversé et réfrigérer dans un réfrigérateur à 2-8 ° C jusqu'à utiliser.
Pour obtenir une gélose MacConkey qui inhibe l'effet allue produit par le genre Protéus Une gélose macconkey basse est utilisée en sel.
Macconkey Agar conventionnel utilise
- L'agar MacConkey est incluse dans tous les ensembles de médias de culture organisés pour le semis des échantillons cliniques reçus en laboratoire. Il est également utile en microbiologie alimentaire et en microbiologie environnementale.
- La variété de bacilles négatifs à Gram qui se développent dans ce milieu expriment les caractéristiques phénotypiques qui aident un diagnostic présumé de l'espèce en question. Par exemple, la taille, la couleur, la consistance et l'odeur des colonies sont quelques-unes des caractéristiques qui peuvent guider.
- Dans cet environnement, l'espèce de Escherichia coli, Klebsiella SP et Enterobacter sp produire de fortes colonies roses, entourées d'une zone biliaire précipitée.
- Tandis que des bactéries telles que Citrobacter SP, Providence SP, Serratia SP et Hafnia SP Ils peuvent apparaître sans couleur après 24 heures, ou rose pâle en 24-48 heures.
- Aussi, les genres Proteus, Edwadsiella, Salmonella et Shigella produire des colonies incolores ou transparentes.
Autres variantes d'agar MacConkey
Il existe d'autres variantes d'agar MacConkey qui ont des objectifs spécifiques. Ils sont mentionnés ci-dessous:
- Agar MacConkey avec Sorbitol: Ce milieu a été conçu pour distinguer la souche entéropathogène (Escherichia coli Enterohemorrágica o157: h7) du reste des souches de Escherichia coli. Ce milieu change de glucides de lactose pour le sorbitol. Les souches de ET. coli Enterohemorrágicas O157: H7 diffèrent des autres car ils ne ferment pas de sorbitol et, par conséquent, des colonies transparentes sont obtenues, cependant, le reste des souches ET. coli Oui fermenter le sorbitol et les colonies sont fortes roses.
- Agar MacConkey sans cristal violet ou sel: Cette gélose diffère beaucoup de l'agar MacConkey classique, car le fait de ne pas avoir de cristal violet peut cultiver des bactéries à gramme. D'un autre côté, l'absence de Sal inhibe l'apparence de l'essaimage sur l'agar produite par certains bacilles entériques, comme ceux du genre Protéus, et ainsi faciliter l'isolement de toutes les bactéries présentes, y compris les bactéries à Gram positif.
- Agar MacConkey avec cefopezone: Cette variante MacConkey Agar a été conçue pour isoler initialement Laribacter hongkongensis Et plus tard, ils ont réalisé qu'il était utile d'isoler Arcobacter Butzleri. POURLes MBO sont légèrement incurvés à grambacs bacilles résistants à la céfopérazone. Ces bactéries ont été récemment liées comme provoquant une gastro-entérite et une diarrhée acquises chez les individus asiatiques et européens, profilant comme deux puissants agents pathogènes émergents. L'antibiotique permet d'inhiber la flore qui l'accompagne du tractus gastro-intestinal, qui favorise le développement de ces bactéries, les empêchant de passer inaperçus, car ils nécessitent 72 heures pour se développer.
- Agar MacConkey préparée avec 10% V / V: Cette variante est utile pour l'évaluation des indicateurs sanitaires bactériens de la contamination fécale, y compris les coliformes totaux et les coliformes fécaux dans les eaux salées récréatives (plages et baies). Les chercheurs ont montré que le support préparé de cette manière augmente considérablement la récupération de ces micro-organismes dans l'environnement salin, par rapport à l'utilisation d'agar MacConkey préparée avec de l'eau distillée. En effet, dans le milieu modifié, la croissance des bactéries physiologiques dans un état de latence "viable, mais pas cultivable" est stimulé, par conséquent, ils ne sont pas récupérables dans les milieux conventionnels.
Les références
- Forbes, B., Sahm, D., Weissfeld, un. Diagnostic microbiologique de Bailey & Scott. Pan -American Editorial S.POUR.
- Koneman, E., Allen, S., Janda, W., Schreckenberger, P., Winn, W. Diagnostic microbiologique. Pan -American Editorial S.POUR.

