Agar lia (Iron Lysina) Qu'est-ce que la fondation, la préparation, les utilisations
- 2672
- 840
- Adam Mercier
Il Agar lia (Iron Lysina) Il s'agit d'un test biochimique utilisé pour l'identification des bactéries de la famille Enterobacteriaceae. Ce médium a été créé par Edwards et Fife, basé sur la formule Falkow.
À l'origine, ce test était un bouillon contenant des peptones, de l'extrait de levure, du glucose, de la l-lisin, du bromocresh et de l'eau distillée violette. Edwards et Fife ont ajouté l'agar-adagar, le citratus ferrique de l'ammonium et du tiosulfate de sodium.
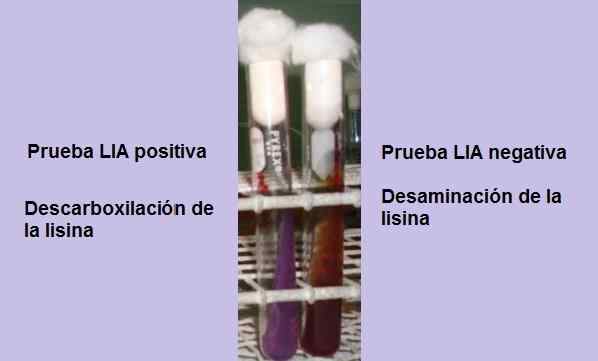
 Test positif et négatif de la décarboxylation de la lysine. Source: Photo et schéma appartenant à l'auteur MSC. Marielsa Gil
Test positif et négatif de la décarboxylation de la lysine. Source: Photo et schéma appartenant à l'auteur MSC. Marielsa Gil Le test consiste essentiellement à démontrer la présence de l'enzyme rudboxylase, capable de réagir avec le groupe carboxyle de l'acide aminé L-lisin. Une désamination de l'acide aminé peut également se produire en raison de la présence de l'enzyme lysine chagrin.
De plus, la composition du milieu permet de démontrer la capacité de certains genres bactériens à produire du sulfure d'hydrogène. Enfin, il est également possible d'observer la génération ou non de gaz au milieu.
Base
Peptonas et extrait de levure
Comme la plupart des milieux de culture, la gélose en fer de lisine contient des composants qui fournissent la source de nutriments nécessaires à la croissance bactérienne. Ces composants sont représentés par des peptones et de l'extrait de levure.
Glucose
De même, cette gélose contient comme glucose de glucides fermensible. Il est connu que toutes les bactéries de la famille Enterobacteriaceae ferment le glucose.
Cette étape est cruciale, car elle sera chargée d'acidifier l'environnement, une condition indispensable pour l'enzyme lysine décarboxylase - si elle est présente - agit sur son substrat.
Dans certains genres bactériens, la production de gaz peut être observée en raison de la fermentation du glucose.
Le gaz est mis en évidence lorsqu'un déplacement de l'agar OCC.
Peut vous servir: biomatériauxL-lisina
Une fois la lysine décarboxylée, une diamine (cadavérine) et un anhydride carbonique se forment.
L'arrêt se produit en présence de la coenzyme du phosphate pyridoxal. Cette réaction est irréversible.
Indicateur de pH (Bromocresol Purple)
Tous les changements de pH se sont produits au milieu par les différentes réactions, sont détectées par l'indicateur de pH de pH de Bromocresol.
En ce sens, en cas d'acidification, le milieu devient jaune, et lorsqu'il y a une alcalisation, le milieu revient à la couleur violette ou violette d'origine.
Lorsque le chagrin de Lysine se produit en raison de la présence de l'enzyme lysine, une couleur rougeâtre se forme à la surface, typique de la Proteus, de la Providence et de certaines espèces de Morganella.
Cela est dû au fait que pendant le processus de désamination, l'acide alpha-zo-carbonique est formé, qui réagit avec le citrate d'ammonium en présence d'oxygène, ce qui provoque la couleur susmentionnée.
Citrate ferrique de l'ammonium et du tiosulfate de sodium
D'un autre côté, les bactéries qui produisent du sulfure d'hydrogène seront des preuves2S.
Les bactéries qui ont la réduction de l'enzyme de thiosulfate ont la capacité d'agir en réduisant le thiosulfate de sodium actuel, en formant du sulfite et du sulfure d'hydrogène (H2S).
Ce dernier est un gaz incolore, mais lorsqu'il réagit avec le sel de fer forme du sulfure métallique, qui est un composé insoluble (précipité noir visible).
Cependant, la capacité de formation de H2S avec ce milieu n'est pas très fiable, car certaines bactéries décarboxylases négatives capables de produire H2S ne formera pas le précipité noir, car l'acidité du milieu interfère. Par conséquent, il est recommandé de corroborer avec d'autres moyens contenant du fer.
Peut vous servir: neuronesInterprétation du test
Recboxylation de la lysine
Les tubes doivent être lus après 24 heures d'incubation, sinon il y a un risque de mal comprendre la réaction, signalant de faux négatifs.
N'oubliez pas que la première réaction qui se produira sera la fermentation du glucose, donc tous les tubes après 10 à 12 heures deviendront jaune.
Si à la fin du temps d'incubation (24 heures), il y a un fond jaune avec une surface violette ou violette, la réaction est négative. La couleur violette de la surface correspond à l'alcalisation du milieu par l'utilisation de peptones.
Une réaction positive est que là où le fond et la surface du tube sont complètement violets, c'est-à-dire qu'il revient à la couleur d'origine.
Par conséquent, qui détermine la positivité du test est la base ou le bas du milieu. Si vous avez des doutes sur la couleur, il peut être comparé à un tube lia non inoculé.
Désamination de lysine
Un tube qui montre le chagrin de lysine aura une surface rougeâtre grenat et un fond jaune (acide), ou tout le tube rougeâtre grenat.
Cette réaction est interprétée comme un négatif pour la décarboxylation de la lysine, mais positive pour la désamination de lysina.
Cette réaction est définie et interprétée dans le biseau.
Production de sulfure d'hydrogène (h2S)
Une réaction positive est observée par l'apparition d'un précipité noir à travers le milieu ou une partie de celui-ci. Généralement entre le liml de la lunette et la base.
Si le précipité se produit dans tout le tube, il ne sera pas vu les autres réactions qui se produisent au milieu.
Enregistrement des résultats
Lors de l'interprétation du test, les résultats sont enregistrés comme suit:
Peut vous servir: Miller et Urey ExperimentD'abord la lunette est lue, puis l'arrière-plan ou le taco, puis la production de H2S, et enfin la production de gaz.
Exemple: k / a + (-). Ça signifie:
- K: lunette alcaline (couleur violette)
- R: fond acide (jaune), c'est-à-dire une réaction de décarboxylation négative et un chagrin négatif.
- +: Production de sulfure d'hydrogène
- (-): Sans gaz.
préparation
Peser 35 GR du moyen de fer allongé déshydraté et se dissoudre dans un litre d'eau distillée.
Chaud jusqu'à dissoudre complètement l'agar, à bouillir pendant une minute en agitant fréquemment. Distribuez 4 ml du milieu dans des tubes à essai 13/100 avec couvercle de coton.
Stériliser en autoclave à 121 ° C pendant 15 minutes. Retirer de l'autoclave et laisser rester incliné, afin qu'il y ait une base profonde et un biseau court.
Stocker dans un réfrigérateur de 2-8 ° C. Laisser un tempérament avant de semer la tension bactérienne.
La couleur du milieu déshydraté est beige et le milieu violet rougeâtre préparé.
Le pH final du milieu préparé est de 6,7 ± 0.2
Le milieu devient jaune avec un pH égal ou inférieur à 5,2, et est violet à pH 6,5.
Applications
Ce test, ainsi que d'autres tests biochimiques, sont utilisés pour l'identification des bacilles de la famille Enterobacteriaceae.
Le milieu est semé avec une aiguille droite ou, une ou deux perforations sont faites au fond du tube, puis la surface du milieu en zigzag se tenait.
Il est incuba pendant 24 heures à 35-37 ° C dans l'aérobiose. Si nécessaire, il est laissé en incubation pendant 24 heures de plus.
Il est principalement utile pour différencier les espèces négatives de Citrobacter de Salmonellas SP.
Les références
- Mac Faddin J. (2003). Tests biochimiques pour l'identification des bactéries d'importance clinique. 3e édition. Éditorial Pan-American. Buenos Aires. Argentine.
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnostic microbiologique de Bailey & Scott. 12 ed. Pan -American Editorial S.POUR. Argentine.

