Caractéristiques de l'actine, structure, filaments, fonction
- 2129
- 178
- Lucas Schneider
La Actine C'est une protéine cytosolique qui forme des microfilaments. Dans les eucaryotes, l'actine est l'une des protéines les plus abondantes. Par exemple, il représente 10% en poids de la protéine totale dans les cellules musculaires; et entre 1 et 5% de la protéine dans les cellules non musculaires.
Cette protéine, à côté des filaments et microtubules intermédiaires, forme le cytosquelette, dont la fonction principale est la mobilité de la cellule, le maintien de la forme cellulaire, la division cellulaire et le mouvement des organites dans les plantes, les champignons et les animaux.
 Source: Sarcomère.SVG: David Richfield (utilisateur Slashme) Travail dérivé: Retama [CC BY-SA 3.0 (http: // CreativeCommons.Org / licences / by-sa / 3.0 /]]
Source: Sarcomère.SVG: David Richfield (utilisateur Slashme) Travail dérivé: Retama [CC BY-SA 3.0 (http: // CreativeCommons.Org / licences / by-sa / 3.0 /]] Isoformes du cytosquelette d'actine.
Du point de vue évolutif, l'actine est une protéine très conservée. Il y a environ 90% d'homologie de séquence chez différentes espèces. Dans les organismes unicellulaires, un seul gène code pour une actine Isaform. Pendant que dans des organismes multicellulaires, différents gènes codent plusieurs Isaforms d'actine.
L'actine, ainsi que la myosine, étaient des structures cruciales dans l'avenir évolutif des organismes eucaryotes et leur diversification, car ils ont permis au mouvement en l'absence d'autres structures, telles que les flagelles et les cils.
[TOC]
Structure: filaments d'actine
L'actine est une seule protéine globulaire de chaîne polypeptidique. Dans le muscle, l'actine a une masse moléculaire d'environ 42 kDa.
Cette protéine a deux domaines. Chacun a deux sous-domaines et une fente entre les domaines. L'ATP-MG+2 rejoint le bas de la fente. Les terminaux amino et carboxil se réunissent dans le sous-domaine 1.
Actina g et actina f
Il existe deux principales formes d'actine: le monomère d'actine, appelé actina G; et un polymère filamenteux, composé de monomères d'actin g, appelé actina f. Les filaments d'actine, observés par microscopie électronique, ont des régions étroites et larges, respectivement de 7 nm et 9 nm de diamètre.
Tout au long du filament, les monomères d'actine forment une double hélice serrée. Une unité qui est répétée tout au long du filament se compose de 13 hélices et de 28 monomères d'actine, et a une distance de 72 nm.
Le filament d'actin a deux extrémités. On forme la fente qui relie l'ATP-MG+2, qui est situé dans la même direction dans tous les monomères d'actine du filament, appelé la fin (-); Et l'autre extrémité est l'inverse, appelé la fin (+). Par conséquent, on dit que le filament d'actin a une polarité.
Plusieurs fois, ces composants sont appelés microfilaments, car ce sont les composants du cytosquelette qui présentent moins de diamètre.
Où trouvons-nous l'actin?
L'actine est une protéine extrêmement courante dans les organismes eucaryotes. De toutes les protéines cellulaires, l'actine représente environ 5 à 10% - selon le type de cellule. Dans le foie, par exemple, chacune des cellules qui constituent qu'il en a presque 5.dix8 Molécules d'actine.
Caractéristiques
Les deux formes d'actine, de monomère et de filament se trouvent continuellement dans un équilibre dynamique entre la polymérisation et les dépolymères. En général, il existe trois caractéristiques de ce phénomène:
1) Les filaments d'actine sont typiques de la structure du tissu musculaire et du cytosquelette des cellules eucaryotes.
Peut vous servir: les 10 caractéristiques des lipides les plus remarquables2) La polymérisation et la dépolimérisation sont un processus dynamique qui est régulé. Où la polymérisation ou l'agrégation des monomères d'actine G-ATP-MG+2 Ça arrive aux deux extrémités. Que ce processus se produit dépend des conditions du milieu et des protéines régulatrices.
3) La formation de poutres et de réticules, qui composent le cytosquelette d'actine, donne de la force à la motilité cellulaire. Cela dépend des protéines qui participent à la formation de liaisons transversales.
Les fonctions
Contraction musculaire
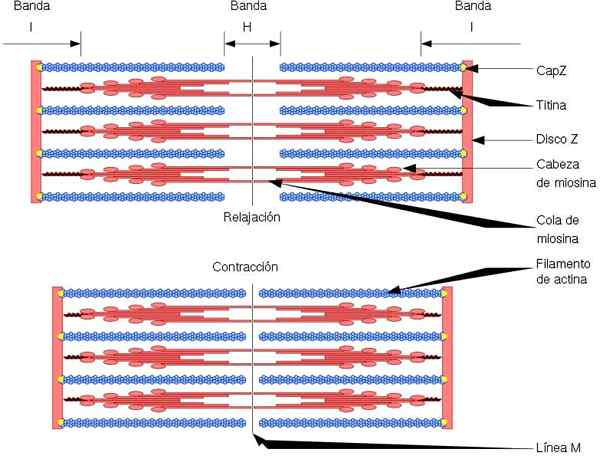
L'unité fonctionnelle et structurelle du muscle squelettique est le sarcomère, qui a deux types de filaments: des filaments minces, formés par l'actine, et des filaments épais, formés par la myosine. Les deux filaments sont organisés alternativement, d'une manière géométrique précise. Autoriser la contraction musculaire.
Les filaments minces sont ancrés dans les régions appelées disques z. Cette région se compose d'un réseau de fibres, dans lequel se trouve la protéine Capz, et auxquels les extrémités (+) des filaments d'actine sont ancrées. Cette ancre empêche la dépolérisation finale (+).
D'un autre côté, aux extrémités (-) des filaments d'actine, la tropomoduline est située et les protège contre la dépolymerie. En plus de l'actine, les filaments minces ont une tropomiosine et une troponine, qui ont la fonction de contrôler les interactions d'actomiosine.
Comment se produit la contraction musculaire?
Pendant la contraction musculaire, les filaments épais font des mouvements de pivot et tirent les filaments minces vers le milieu du sarcomère. Cela produit le glissement des fibres épaisses et minces.
Ainsi, la longueur des filaments épais et minces reste constant, mais augmente le chevauchement entre les deux filaments. La longueur du sarcomère diminue par l'ancrage de filaments minces aux disques z.
Comment s'arrête la contraction musculaire?
L'ATP est la monnaie énergétique de la cellule. Par conséquent, il est presque toujours disponible dans les tissus musculaires vivants. Compte tenu de ce qui précède, il doit y avoir des mécanismes qui permettent la relaxation musculaire et l'arrestation des contractions.
Deux protéines, appelées tropomiosine et troponine, ont un rôle fondamental dans ce phénomène. Ceux-ci travaillent ensemble pour bloquer les sites syndicaux de la myosine (empêchant ainsi leur union avec l'actine). En conséquence, le muscle se détend.
Contraire, lorsqu'un animal décède un phénomène connu sous le nom de rigor de mort. La personne responsable de ce durcissement du corps est le blocage de l'interaction entre la myosine et l'actine, peu de temps après la mort de l'animal.
L'une des conséquences de ce phénomène est la nécessité de l'ATP pour la libération des deux molécules de protéines. Logiquement, il n'y a pas de disponibilité ATP dans les tissus morts et cette version ne peut pas se produire.
Autres types de mouvement
Le même mécanisme que nous décrivons (plus tard, nous approfondirons le mécanisme qui sous-tend le mouvement) n'est pas limité aux contractions musculaires des animaux. Il est responsable des mouvements ameboïdaux que nous observons dans les amibes et dans certains moules coloniaux.
De la même manière, le mouvement cytoplasmique que nous observons dans les algues et les plantes terrestres est dirigée par des mécanismes similaires.
Régulation de la polymérisation et de la dépolymérisation du filament d'actine
La contraction du tissu musculaire lisse et des cellules produit une augmentation de l'actine F et une diminution de l'actine g. La polymérisation de l'actine se produit en trois étapes: 1) la nucléation, un pas lent; 2) allongement, un pas rapide; et 3) statut stable. La vitesse de polymérisation est égale au taux de dépolymérisation.
Peut vous servir: Théorie des fixistes: concept, postulates et auteursLe filament d'actine se développe plus rapidement à la fin (+) que la fin (-). La vitesse d'allongement est proportionnelle à la concentration de monomères d'actine en équilibre avec les filaments d'actine, appelés concentration critique (CC).
Le CC pour l'extrémité (+) est de 0,1 µm, et pour la fin (-) est de 0,8 µm. Cela signifie que 8 fois moins de concentration de monomères d'actine est nécessaire pour polymériser la fin (+).
La polymérisation de l'actine est principalement régulée par les escroqueries bêta4 (TB4). Cette protéine unit l'actine G et la conserve, empêchant la polymérice. Tandis que la propyline stimule la polymérisation de l'actine. Le profil se lie aux monomères d'actine facilitant la polymérisation par la fin (+), par dissociation du complexe d'actine-TB4.
D'autres facteurs tels que l'augmentation des ions (Na+, K+ ou mg+2) privilégier la formation de filaments.
Formation du cytosquelette d'actine
La formation du cytosquelette d'actine exige l'élaboration de liaisons transversales entre les filaments d'actine. Ces liens forment des protéines, dont les points forts sont: ils ont des domaines d'union à l'actine; Beaucoup ont des domaines homologues en calponine; et chaque type de protéine est exprimé dans un certain type de cellule.
Dans les philopodes et les fibres de stress, les liaisons transversales entre les filaments d'actine sont faites par Fascin et Philamine. Ces protéines, respectivement, rendent les filaments d'actine parallèles ou ont des angles différents. Par conséquent, les filaments d'actine définissent la forme de la cellule.
La région cellulaire avec la plus grande quantité de filaments d'actine est située près de la membrane plasmique. Cette région est appelée cortex. Le cytosquelette cortical est organisé sous différentes formes, selon le type de cellule, et se connecte à la membrane plasmique par la fixation des protéines.
Certains des cytosquelettes les mieux décrits sont les cellules musculaires, les plaquettes, les cellules épithéliales et les érythrocytes. Par exemple, dans les cellules musculaires, la protéine fixative de dystrophine rejoint les filaments d'actine à un complexe glycoprotéique complet de la membrane. Ce complexe se lie aux protéines matricielles extracellulaires.
Modèle d'interaction actine-miosine
Des chercheurs dirigés par Rayment ont proposé un modèle à quatre étapes pour expliquer l'interaction de l'actine et de la myosine. La première étape se produit avec l'union d'ATP à Myosin Heads. Cette union génère un changement conformationnel dans la protéine, le libérant de l'actine dans le petit filament.
Ensuite, l'ATP est hydrolysé en ADP, libérant un phosphate inorganique. La molécule de myosine est ancrée dans une nouvelle sous-unité d'actine, générant un état d'énergie élevé.
La libération de phosphate inorganique entraîne un changement de myosine, revenant à la conformation initiale et au mouvement des petits filaments, par rapport aux filaments épais, par rapport aux filaments épais. Ce mouvement provoque le mouvement des deux extrémités du sarcomère, s'approchant d'eux.
La dernière étape implique la libération d'ADP. À ce stade, la tête de la myosine est gratuite et peut rejoindre une nouvelle molécule ATP.
Il peut vous servir: Biologie: Histoire, quelles études, branches, basesMouvement cellulaire entraîné par la polymérisation de l'actine
La motilité du recteur est un type de motilité cellulaire. Les étapes de ce type de motilité sont: la projection de l'axe principal d'adhésion au substrat; adhérence au substrat; rétraction arrière; et des-adhésions.
La projection de l'axe principal nécessite la participation des protéines, qui participent à la polymérisation et à la dépolimérisation des filaments d'actine. L'axe d'attaque est situé dans le cortex cellulaire, appelé lamellipodio. Les étapes de projection de l'axe sont:
- Activation des récepteurs par signal extracellulaire.
- Formation de GTPASAS actifs et de 4,5 évêques phosphoinositol (PIP2).
- L'activation des protéines WASP / Scar et ARP2 / 3, qui se lient aux monomères d'actine pour former des ramifications dans les filaments d'actine.
- Croissance rapide des filaments d'actine, à la fin décorés de myosine, de ramification. La poussée de la membrane est produite en avant.
- Culmination de l'allongement produit par les protéines de couverture.
- Hydrolyse ATP attachée à l'actine dans les filaments les plus anciens.
- Dépolimérisation de l'actine-AD des filaments promus par ADF / Cofilina.
- ADP Exchange by ATP catalysé par le prophylaine, générant de l'actine G-ATP prêt à commencer les ramifications Elongar.
Maladies liées à l'actine
Distrophie musculaire
La dystrophie musculaire est une maladie dégénérative du muscle squelettique. Il est hérité de manière réceptionnelle et est lié au chromosome X. Affecte principalement les hommes à haute fréquence dans la population (un sur 3.500 hommes). Les mères de ces hommes sont hétérozygotes asymptomatiques et peuvent manquer d'histoire familiale.
Il existe deux formes de dystrophie musculaire, Duchenne et Becker, et les deux sont causés par des défauts dans le gène de la dystrophine. Ces défauts sont constitués de suppressions qui éliminent les axones.
La dystrophine est une protéine (427 kDa) qui forme des liaisons croisées entre les filaments d'actine. Il a une maîtrise de l'union à l'actine dans le N-terminal, et une maîtrise de l'union membranaire dans le C-terminal. Entre les deux domaines, il y a un troisième domaine tubulaire formé par 24 répétitions en tandem.
Dans le réticulum cortical musculaire, la dystrophine participe à l'union des filaments d'actine à la membrane plasmique à travers un complexe glycoprotéique. Ce complexe se lie également aux protéines matricielles extracellulaires.
Chez les patients qui manquent de dystrophine fonctionnelle, avec la dystrophie musculaire de Duchenne, le cytosquelette cortical ne soutient pas la membrane plasmique. Par conséquent, la membrane plasmique est endommagée par le stress des contractions musculaires répétées.
Les références
- Devlin, t.M. 2000. Biochimie. Reverté éditorial, Barcelone.
- Gunst, s.J., et zhang, w. 2008. Dynamique du cytosquelette d'actine dans les muscles lisses: un nouveau paradigme pour la régulation de la contraction des muscles lisses. Am J Physiol Cell Physiol, 295: C576-C587.
- Lodish, H., Berk, un., Zipurski, S.L., Matsudaria, P., Baltimore, D., Darnell, J. 2003. Biologie cellulaire et moléculaire. Éditorial Medica Panamericana, Buenos Aires, Bogotá, Caracas, Madrid, Mexique, Sāo Paulo.
- Nelson, D. L., Cox, M. M. 2008. Lehninger-primeciples de biochimie. W.H. Freeman, New York.
- Pfaendtner, J., De la croix, et. M., Voth, G. 2010. Remodelage du filament d'actine par le facteur de dépolymérisation de l'actine / cofiline. PNAS, 107: 7299-7304.
- Pollard, t.D., Borisy, g.g. 2003. Motilité cellulaire entraînée par l'assemblage et le démontage de la faillament de l'actine. Cell, 112: 453-465.
- « Apolipoprotéines quels sont les fonctions, les types
- Structure d'alcool primaire, propriétés, nomenclature, exemples »

