L'acétate d'éthyle
- 1554
- 139
- Prof Ines Gaillard
Il acétate d'éthyle ou d'éthyle d'éthane C'est un composé organique dont la formule chimique est Cho3Cooc2H5. Il se compose d'un ester, où le composant alcoolique dérive de l'éthanol, tandis que son composant d'acide carboxylique provient d'acide acétique.
C'est un liquide dans des conditions de température et de pression normales, présentant un arôme agréable aux fruits. Cette propriété entre parfaitement en harmonie, il est donc attendu d'un ester; qui est en fait la nature chimique de l'acétate d'éthyle. Pour cette raison, il trouve une utilisation dans les produits alimentaires et les boissons alcoolisées.
 L'acétate d'éthyle. Source: Commons Wikimedia.
L'acétate d'éthyle. Source: Commons Wikimedia. L'image supérieure montre la structure squelette de l'acétatode d'éthyle. Notez son composant d'acide carboxylique et à droite le composant alcoolique. D'un point de vue structurel, ce composé devrait se comporter comme un hybride entre le vinaigre et l'alcool; Cependant, il présente ses propres propriétés.
C'est là que de tels hybrides appelés esters se démarquent pour être différent. L'acétate d'éthyle ne peut pas réagir comme un acide, ni déshydrater par l'absence d'un groupe OH. Au lieu de cela, il subit une hydrolyse de base en présence d'une base forte, comme l'hydroxyde de sodium, NaOH.
Cette réaction d'hydrolyse est utilisée dans les laboratoires d'enseignement pour les expériences de cinétique chimique; où la réaction, en outre, est du second ordre. Lorsque l'hydrolyse se produit, l'éthanoate d'Ethil.
Dans son squelette structurel, il est observé que les atomes d'hydrogène sur l'oxygène prédominent. Cela influence sa capacité à interagir avec non pas des espèces polaires que les graisses. Il est également utilisé pour dissoudre des composés tels que les résines, les colorants et en général des solides organiques.
Malgré un arôme agréable, une exposition prolongée à ce liquide génère un impact négatif (comme presque tous les composés chimiques) sur le corps.
Structure d'acétate d'éthyle
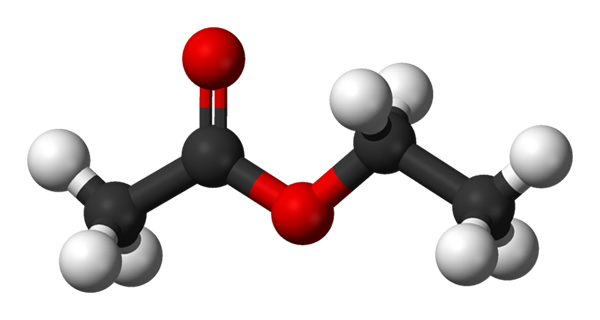
 Modèles de sphères et de barres pour l'acétate d'éthyle. Source: Benjah-Bmm27 [domaine public]
Modèles de sphères et de barres pour l'acétate d'éthyle. Source: Benjah-Bmm27 [domaine public] L'image supérieure montre la structure de l'acétate d'éthyle avec un modèle de sphères et de barres. Dans ce modèle, les atomes d'oxygène avec des sphères rouges sont mis en évidence; À sa gauche se trouve la fraction dérivée de l'acide, et à droite, la fraction dérivée de l'alcool (alcoxi, -or).
Peut vous servir: électrolytes faibles: concept, caractéristiques, exemplesLe groupe carbonyle peut être vu par Link C = O (les doubles barres). La structure autour de ce groupe et l'oxygène adjacent est plate, car il y a une relocalisation de la charge de résonance entre les deux oxygène; fait qui explique une acidité relativement faible des hydrogènes α (ceux du groupe -ch3, lié à c = o).
La molécule, tournant deux de ses liaisons, favorise directement la façon dont l'interaction avec d'autres molécules. La présence des deux atomes d'oxygène et l'asymétrie dans la structure lui donnent un moment dipolaire permanent; qui à son tour est responsable de ses interactions dipol-dipole.
Par exemple, la densité électronique est plus grande près des deux atomes d'oxygène, diminuant considérablement dans le groupe -ch3, Et progressivement dans le groupe OCH2Ch3.
En raison de ces interactions, les molécules d'acétate d'éthyle forment un liquide dans des conditions normales, qui a un point d'ébullition considérablement élevé (77 ° C).
Absence d'atomes donneurs de ponts d'hydrogène
Si la structure est soigneusement observée, l'absence d'un atome capable de donner un pont d'hydrogène sera remarquée. Cependant, les atomes d'oxygène sont des accepteurs de tels, et l'acétate d'éthyle est très soluble dans l'eau et interagit dans une mesure estimée avec les composés polaires et les donneurs de ponts d'hydrogène (comme les sucres).
Il vous permet également d'interagir parfaitement avec l'éthanol; La raison pour laquelle sa présence dans les boissons alcoolisées n'est pas surpris.
D'un autre côté, son groupe alcoxi le fait capable d'interagir avec certains composés apolaires, comme le chloroforme, le ch3CL.
Proprietes physiques et chimiques
Des noms
-L'acétate d'éthyle
-Éthanoate d'éthyle
-Éthyle acétique
-Acétoxietano
Formule moléculaire
C4H8SOIT2 ou ch3Cooc2H5
Poids moléculaire
88 106 g / mol.
Description physique
Liquide sans molodi.
Couleur
Liquide incolore.
Odeur
Caractéristique des éthers, semblable à l'odeur de l'ananas.
Saveur
Nice lorsqu'il est dilué, il apporte une saveur de fruits à la bière.
Seuil d'odeur
3,9 ppm. 0,0196 mg / m3 (Basse odeur); 665 mg / m3 (Odeur élevée).
Peut vous servir: liaison chimiqueOdeur déficiente à 7 à 50 ppm (moyenne = 8 ppm).
Point d'ébullition
171 ºF à 760 mmHg (77,1 ºC).
Point de fusion
-118,5 ºF (-83,8 ºC).
Solubilité dans l'eau
80 g / l.
Solubilité dans les solvants organiques
Miscible avec l'éthanol et l'éther éthylique. Très soluble dans l'acétone et le benzène. Miscible avec le chloroforme, les huiles fixes et volatiles, ainsi que les solvants oxygénés et chlorés.
Densité
0,9003 g / cm3.
Densité de vapeur
3.04 (dans la relation aérienne: 1).
La stabilité
Il se décompose lentement d'humidité; incompatible avec plusieurs plastiques et agents oxydants forts. Le mélange avec de l'eau peut être explosif.
La pression de vapeur
93,2 mmHg à 25 ºC
Gelée
0,423 mpoise à 25 ° C.
Chaleur de combustion
2.238,1 kJ / mol.
Chaleur de vaporisation
35,60 kJ / mol à 25 ºC.
Tension superficielle
24 dynas / cm à 20 ºC.
Indice de réfraction
1 373 à 20 ºC / J.
Température de stockage
2 - 8 ºC.
Pka
16 - 18 à 25 ºC.
La synthèse
Réaction de pêcheur
L'acétate d'éthyle est synthétisé industriellement par la réaction de Fisher, dans laquelle l'éthanol est estérifié avec de l'acide acétique. La réaction est effectuée à température ambiante.
Ch3Ch2Oh + ch3COOH CH3COOCH2Ch3 + H2SOIT
La réaction est accélérée par la catalyse acide. L'équilibre se déplace vers la droite, c'est-à-dire vers la production d'acétate d'éthyle, en éliminant l'eau; Selon la loi sur l'action de masse.
Réaction de Tishchenko
L'acétate d'éthyle est également préparé industriellement en utilisant la réaction de Tishchenko, conjuguant deux équivalents d'acétaldéhyde avec l'utilisation d'un catalyseur comme catalyseur.
2 ch3Cho => cho3COOCH2Ch3
Autres méthodes
-L'acétate d'éthyle est synthétisé comme un co-produit dans l'oxydation du butane en acide acétique, dans une réaction effectuée à une température de 175 ºC et 50 atm de pression. Il est utilisé comme catalyseur de cobalt et ions chromés.
-L'acétate d'éthyle est un co-produit de l'éthanoly à acétate de polyvinyle.
-L'acétate d'éthyle est également produit dans l'industrie par déshydrogénation de l'éthanol, catalysant la réaction en utilisant du cuivre à haute température, mais moins de 250 ºC.
Applications
Solvant
L'acétate d'éthyle est utilisé comme solvant et diluant, en utilisant des circuits imprimés pour nettoyer. Il est utilisé comme solvant dans la fabrication d'extrait de houblon modifié et dans le café décaféiné et les feuilles de thé. Il est utilisé dans les encres utilisées pour marquer les fruits et légumes.
Il peut vous servir: acide cyanhydrique: structure moléculaire, propriétés, utilisationsL'acétate d'éthyle est utilisé dans l'industrie textile en tant qu'agent nettoyant. Est utilisé dans l'étalonnage des thermomètres, utilisé dans la séparation des sucres. Dans l'industrie de la peinture, il est utilisé comme solvant et diluant des matériaux utilisés.
Saveurs artificielles
Il est utilisé dans l'élaboration des saveurs de fruits; Par exemple: banane, poire, pêche et ananas, ainsi que l'arôme de raisin, etc.
Analytique
Il est utilisé dans la détermination du bismuth, du bore, de l'or, du molybdène et du platine, ainsi que du solvant du talium. L'acétate d'éthyle a la capacité d'extraire de nombreux composés et éléments présents dans une solution aqueuse, comme: phosphore, cobalt, tungstène et arsenic.
Synthèse organique
L'acétate d'éthyle est utilisé dans l'industrie comme réducteur de la viscosité des résines utilisées dans les formulations de photoorestoning. Il est utilisé dans la production d'acétamide, l'acétate d'acétyle et la méthyle heptanone.
Chromatographie
Dans les laboratoires, l'acétate d'éthyle est utilisé comme phase mobile des chromatographies dans les colonnes et comme solvant d'extraction. Ayant de l'acétate d'éthyle un point d'ébullition relativement faible, il est facile à évaporation, ce qui vous permet de concentrer les substances dissous dans le solvant.
Entomologie
L'acétate d'éthyle est utilisé en entomologie pour étouffer les insectes placés dans un conteneur, permettant sa collection et à l'étude. Les vapeurs d'acétate d'éthyle tuent l'insecte sans la détruire et éviter leur durcissement, facilitant leur ensemble de collecte.
Des risques
-Le LDcinquante À partir de l'acétate d'éthyle chez le rat, il indique une faible toxicité. Cependant, il peut irriter la peau, les yeux, la peau, le nez et la gorge.
-L'exposition à des niveaux élevés peut provoquer des étourdissements et des évanouissements. De même, une exposition à long terme peut affecter le foie et les reins.
-Inhalation de l'acétate d'éthyle à une concentration de 20.000 - 43.000 ppm, peut produire un œdème pulmonaire et une hémorragie.
-La limite d'exposition de travail a été fixée par l'OSHA à 400 ppm dans les airs, en moyenne, lors d'un quart de travail de 8 heures.
Les références
- Glossaire illustré de la chimie organique: acétate d'éthhyle (ETOAC). Récupéré de: Chem.Ucla.Édu
- Acétate d'éthhyle. Récupéré de: CHM.Bris.CA.ROYAUME-UNI

