Oxyde de potassium (K2O)
- 4461
- 148
- Lucas Schneider
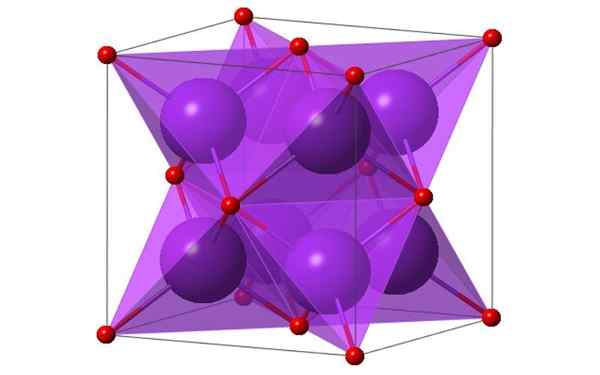
 Conception cubique de 4 molécules d'oxyde de potassium. Source: Ktlabe, Wikimedia Commons
Conception cubique de 4 molécules d'oxyde de potassium. Source: Ktlabe, Wikimedia Commons Qu'est-ce que l'oxyde de potassium?
Il oxyde de potassium, Également appelé oxyde de dipotasium, c'est un oxygène ionique et un sel de potassium, avec la formule K2SOIT. C'est l'oxyde de potassium le plus simple, hautement réactif et rarement trouvé. Certains matériaux commerciaux, tels que les engrais et le ciment2SOIT.
L'oxyde de potassium est produit à partir d'hydroxyde de potassium (potasse caustique) et de potassium métallique 450 ° C, produisant de l'hydrogène moléculaire selon l'équation:
2K + 2KOH ⇌ 2K2Ou + h2 (450 ° C).
Il est également obtenu en réduisant le peroxyde de potassium en fonction de la réaction:
2K2SOIT2 → K2Ou + o2 (530 ° C).
Une autre méthode d'obtention de l'oxyde de potassium est en chauffant le carbonate de potassium à haute température, comme indiqué par la réaction suivante:
K2CO3 ⇌ K2O + Co₂ (t> 1200 ° C).
Cependant, la principale façon d'obtenir l'oxyde de potassium est par chauffage du nitrate de potassium, en obtenant de l'azote moléculaire comme indiqué par la réaction suivante:
2kno3 + 10K → 6K2Ou + n2
Proprietes physiques et chimiques
- Ce sont des cristaux tétraédriques, jaunâtres, sans arôme caractéristique.
- Il a un poids moléculaire de 94,2 g / mol et une densité de 2,13 g / ml à 24 ° C.
- Il a un point de fusion de 740 ° C, bien qu'il commence à se décomposer à 300 ° C.
- Il résiste à la chaleur et soluble dans l'éthanol et l'éther. K2Ou cristalliser dans la structure antifluorite. Pour cette raison, les positions des anions et des cations sont investies par rapport à leurs positions dans les CAF2, avec des ions de potassium coordonnés à 4 ions d'ions et d'ions oxyde coordonnés à 8 potassium.
- C'est un oxyde de base et réagit violemment de l'eau pour produire de l'hydroxyde de potassium caustique. Il est délicoscent et absorbe l'eau de l'atmosphère, commençant cette réaction vigoureuse.
Il peut vous servir: nitrate de calcium (CA (NO3) 2)- Il s'oxyde de manière réversible au peroxyde de potassium à 350 ° C, réagit violemment avec les acides, tels que l'acide chlorhydrique, pour former des sels de potassium selon la réaction:
K2O + 2HCL → 2KCL + H₂O.
- Réagit avec le dioxyde d'azote pour former du nitrate et du nitrite de potassium à des températures comprises entre 150 et 200 ° C:
K2O + 2NO2 = KNO2 + Kno3
- Réagir à basse température avec de l'ammoniac pour former des amides et de l'hydroxyde de potassium en fonction de la réaction:
K2O + NH3 (L) → KNH2↓ + KOH (-50 ° C).
Des risques
L'oxyde de potassium est une substance instable. Oxyde facilement d'autres oxydes de potassium, de peroxyde ou de potassium (KHO) (KHO). Le composé n'est pas du carburant, mais il réagit vigoureusement et exothermiquement avec de l'eau pour former l'hydroxyde de potassium (KOH).
La solution d'oxyde de potassium dans l'eau est une base forte, réagit violemment avec l'acide et est corrosif. Réagit violemment avec l'eau qui produit de l'hydroxyde de potassium. Attaque de nombreux métaux en présence d'eau.
La substance est corrosive pour les yeux, la peau et les voies respiratoires, ainsi qu'en ingérant. L'inhalation des aérosols peut provoquer un œdème pulmonaire, dont les symptômes se manifestent souvent après quelques heures et sont aggravés par l'effort physique.
En cas de contact visuel, vous devez vérifier si les lentilles de contact sont utilisées et les retirer immédiatement. Les yeux doivent être lavés à l'eau courante pendant au moins 15 minutes, avec des paupières ouvertes. L'eau froide peut être utilisée, et non une pommade oculaire.
Si le produit chimique entre en contact avec les vêtements, conservez-le le plus rapidement possible, en protégeant ses propres mains et son corps. Placer la victime sous une douche de sécurité.
Si le produit chimique s'accumule dans la peau exposée, comme les mains, la peau contaminée par l'eau courante et le savon non abrasif est doucement lavé et soigneusement. L'eau froide peut être utilisée. Si l'irritation persiste, consulter un médecin. Laver les vêtements contaminés avant de l'utiliser à nouveau.
Il peut vous servir: Rubidio: Historique, propriétés, structure, obtention, utilisationsSi le contact de la peau est grave, il doit être lavé avec un savon désinfectant et couvrir la peau contaminée par une crème antibactérienne.
En cas d'inhalation, la victime devrait être autorisée à se tenir dans une zone bien ventilée. Si l'inhalation est grave, la victime doit être évacuée dans une zone sûre dès que possible.
Desserrer les vêtements serrés, comme des cou de chemise, des ceintures ou une cravate. Si la victime est difficile à respirer, l'oxygène doit être administré. Si la victime ne respire pas, une réanimation buccale est faite.
Compte tenu toujours de prendre en compte que cela peut être dangereux pour la personne qui fournit une aide à la réanimation bouche à bouche lorsque le matériau inhalé est toxique, infectieux ou corrosif.
En cas d'ingestion, il n'induit pas de vomissements. Desserrer les vêtements serrés. Dans tous les cas, des soins médicaux immédiats doivent être recherchés.
Applications
- La formule chimique K2Ou (ou simplement k) est utilisé dans plusieurs contextes industriels: nombres N-P-K pour les engrais, les formules de ciment et les formules de verre.
Il n'est souvent pas utilisé directement dans ces produits, mais la quantité de potassium est signalée en termes de k équivalent2Ou pour tout type de composés de potassium utilisés, comme le carbonate de potassium.
- L'oxyde de potassium représente environ 83% du poids du potassium, tandis que le chlorure de potassium n'est que de 52%. Le chlorure de potassium offre moins de potassium qu'une quantité égale d'oxyde de potassium.
Par conséquent, si un engrais est de 30% de chlorure de potassium en poids, son indice de potassium standard, basé sur l'oxyde de potassium, ne serait que de 18,8%. Il est fabriqué et / ou entre 10 et 100 tonnes par an de cette substance dans l'espace économique européen.
Peut vous servir: chimie dans la vie quotidienne: +30 exemples- Cette substance est utilisée dans les produits chimiques de laboratoire, les engrais, les polymères et les produits phytosanitaires. Le K2O Il a une utilisation industrielle qui se traduit par la fabrication d'une autre substance (utilisation de produits intermédiaires).
- L'oxyde de potassium est utilisé dans les zones du mélange et / ou de l'agriculture, de la formulation forestière et de la pêche. Il est utilisé pour la fabrication de produits chimiques, de produits en plastique et de produits minéraux (par exemple, plâtre, ciment).
- Il est utilisé à l'extérieur dans des matériaux à long terme avec une libération à faible vitesse, par exemple, les matériaux de construction en métal, en bois et en plastique.
- Les matériaux intérieurs, à long terme sont utilisés avec une vitesse à faible réalité, comme les meubles, les jouets, les matériaux de construction, les rideaux, les chaussures, les produits en cuir, les produits en papier et en carton, un équipement électronique.
- Cette substance peut être trouvée dans les produits avec des matériaux à base de pierre, du plâtre, du ciment, du verre ou de la céramique (par exemple, des assiettes, des pots / casseroles, des contenants de stockage des aliments, des matériaux de construction et d'isolation).
- L'oxyde de potassium est une source thermiquement stable et très insoluble, adaptée aux applications en verre, optique et en céramique. Les composés d'oxyde ne conduisent pas l'électricité.
- Il est également utilisé dans des composants structurels légers dans les applications aérospatiales et électrochimiques telles que les batteries de carburant dans lesquelles la conductivité ionique présente.
Les références
- Éléments américains (s.F.). Oxyde de potassium. Récupéré des Américains.com.
- Oxyde de dipassium. Récupéré d'Echa.L'Europe .UE.

