Oxyde d'or (III) (AU2O3) Qu'est-ce que la structure, les propriétés, les utilisations
- 3104
- 933
- Lucas Schneider
Il Oxyde d'or (III) C'est un composé inorganique dont la formule chimique est2SOIT3. Théoriquement, sa nature pourrait être attendue en dehors du type covalent. Cependant, la présence d'un certain caractère ionique dans son solide ne peut pas être pleinement exclue; ou quelle est la même chose, supposons l'absence de l'AU cation3+ à côté de l'anion ou2-.
Il peut sembler contradictoire que l'or, étant un noble métal, peut oxyder. Dans des conditions normales, les pièces d'or ne peuvent pas s'oxyder par contact avec l'oxygène de l'atmosphère; Cependant, lorsqu'ils sont irradiés avec un rayonnement ultraviolet en présence d'ozone, ou3, Le panorama est un autre.
Si les étoiles d'or subissent ces conditions, elles deviendraient une couleur brun rougeâtre, caractéristique de l'UA2SOIT3.
D'autres méthodes pour obtenir cet oxyde impliqueraient le traitement chimique de ces étoiles; Par exemple, transformant la pâte d'or en chlorure respectif, AUCL3.
Puis à l'AUCL3, Et le reste des sels d'or possibles formés, un solide milieu de base est ajouté; Et avec cela, l'oxyde hydraté ou hydroxyde est obtenu, Au (OH)3. Enfin, ce dernier composé est déshydraté thermiquement pour obtenir l'UA2SOIT3.
Structure d'oxyde d'or (III)
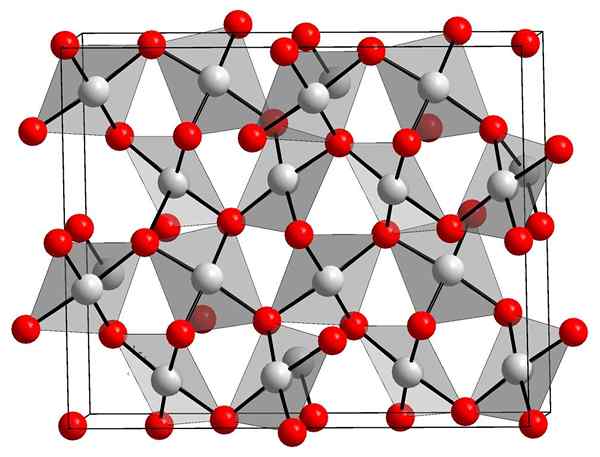
 Structure cristalline d'oxyde d'or. Orci, Wikimedia Commons.
Structure cristalline d'oxyde d'or. Orci, Wikimedia Commons. L'image supérieure montre la structure cristalline de l'oxyde d'or (III). La disposition des atomes d'or et d'oxygène dans le solide est montrée, soit en considérant les atomes neutres (solide covalent), soit ions (solide ionique). Interchangeable, éliminez ou placez simplement les liens au-o dans tous les cas.
Selon l'image, on suppose que le caractère covalent prédomine (ce qui serait logique). Pour cette raison, les atomes et les liens représentés avec des sphères et des barres sont montrés, respectivement. Les sphères blanches correspondent aux atomes d'or (AUIII-O), et les atomes rougeâtre à oxygène.
Peut vous servir: hydroxyapatiteS'il est observé avec soin, on verra qu'il y a des unités auo4, qui se lient par les atomes d'oxygène. Une autre façon de le visualiser serait de considérer que chaque Au3+ est entouré de quatre ou2-; Bien sûr, d'un point de vue ionique.
Cette structure est cristalline car les atomes sont ordonnés en obéissant au même motif à long terme. Ainsi, sa cellule unitaire correspond au système cristallin rhombohédrique (comme l'image supérieure). Par conséquent, tout Au2SOIT3 Il pourrait être construit si toutes ces sphères de la cellule unitaire étaient distribuées dans l'espace.
Aspects électroniques
L'or est un métal de transition, et il est prévu que ses orbitales 5D interagissent directement avec les orbitales 2p de l'atome d'oxygène. Ce chevauchement de ses orbitales doit théoriquement générer des bandes de conduite, ce qui ferait de l'UA2SOIT3 Dans un solide semi-conducteur.
Par conséquent, la véritable structure de l'UA2SOIT3 est encore plus complexe ayant cela à l'esprit.
Hydrater
L'oxyde d'or peut conserver les molécules d'eau à l'intérieur de ses cristaux rhomboédicaniques, qui donne naissance à des hydrates. Lorsque de tels hydrates se forment, la structure devient amorphe, c'est-à-dire désordonnée.
La formule chimique de ces hydrates peut être l'une des éléments suivants, qui ne sont en fait pas profondément clarifiés: Au2SOIT3∙ ZH2O (z = 1, 2, 3, etc.), AU (OH)3, ou auXSOITet(OH)z.
La formule au (oh)3 représente une simplification de la véritable composition de ces hydrates. En effet, dans l'hydroxyde d'or (III), les chercheurs ont également trouvé la présence de l'UA2SOIT3; Et par conséquent, il perd du sens pour le traiter isolément comme un hydroxyde de métal de transition "simple".
Peut vous servir: équilibre de vapeur liquideD'un autre côté, d'une formule solide avec AuXSOITet(OH)z On pourrait s'attendre à une structure amorphe; Puisque cela dépend des coefficients X, et et z, dont les variations entraîneraient tous les types de structure qui pourraient à peine présenter un motif cristallin.
Propriétés
Apparence physique
C'est un solide brun rougeâtre.
Masse moléculaire
441,93 g / mol.
Densité
11,34 g / ml.
Point de fusion
Il fond et se décompose à 160 ° C. Il manque un point d'ébullition, donc cet oxyde ne bouillonne jamais.
La stabilité
Au2SOIT3 Il est thermodynamiquement instable car, comme mentionné au début, l'or n'a pas tendance à s'oxyder dans des conditions de température normales. De sorte qu'il est facilement réduit pour devenir l'or noble.
Plus la température est élevée, plus cette réaction sera rapide, ce qui est connu sous le nom de décomposition thermique. Ainsi, l'AU2SOIT3 À 160 ° C, il se décompose pour produire de l'or métallique et libère de l'oxygène moléculaire:
2 AU2SOIT3 => 4 au + 3 o2
Une réaction très similaire peut se produire avec d'autres composés qui favorisent cette réduction. Pourquoi la réduction? Parce que l'or gagne les électrons que l'oxygène a retiré; Quelle est la même chose que de perdre des liens vers l'oxygène.
Solubilité
C'est un solide insoluble dans l'eau. Cependant, il est soluble dans l'acide chlorhydrique et l'acide nitrique, en raison de la formation de chlorures d'or et de nitrates.
Nomenclature
L'oxyde d'or (III) est le nom régi par la nomenclature des stocks. D'autres façons de le mentionner sont:
-Nomenclature traditionnelle: oxyde aurique, car Valencia 3+ est la plus grande pour l'or.
-Nomenclature systématique: trioxyde de dioro.
Applications
Coloration en verre
L'une de ses utilisations les plus éminentes est de fournir une couleur rougeâtre à certains matériaux, tels que des lunettes, en plus de conférer certaines propriétés inhérentes aux atomes d'or.
Peut vous servir: bromure d'hydrogène (HBR)Synthèse des auriates et de l'or fulminant
Si l'UA est ajouté2SOIT3 À un milieu où il est soluble, et en présence de métaux, il peut précipiter après l'ajout d'une base forte les auriates; qui sont formés par des anions auo4- En compagnie de cations métalliques.
Aussi, l'AU2SOIT3 réagit avec l'ammoniac pour former le composé d'or fulminant, AU2SOIT3(NH3)4. Son nom dérive du fait qu'il est très explosif.
Manipulation de monocapas auto-assemblée
Sur l'or et son oxyde, certains composés ne sont pas adsorbés de la même manière, comme Disulfur Dialil, RSSR. Lorsque cette adsorption se produit, une liaison AU-S se forme spontanément, où l'atome de soufre présente et définit les caractéristiques chimiques de ladite surface en fonction du groupe fonctionnel auquel il est lié.
RSSR ne peut pas être adsorbé sur Au2SOIT3, Mais à propos de l'or métallique. Par conséquent, si la surface de l'or et son degré d'oxydation sont modifiés, ainsi que la taille des particules ou des couches de Au2SOIT3, Une surface plus hétérogène peut être conçue.
Cette surface AU2SOIT3-AUSR interagit avec les oxydes métalliques de certains dispositifs électroniques, développant ainsi de futures surfaces plus intelligentes.
Les références
- Oxydes d'or. Récupéré de: 911metallurgist.com
- Shi, r. Asahi et c. Tampon. (2007). Propriétés des oxydes d'or au2SOIT3 et au2O: Recherche des premiers principes. L'American Physical Society.
- « Chigualcan ce qui est, caractéristiques, habitat, utilisations, propriétés
- Hemidesmosomes ce que c'est, description, structure, fonctions »

