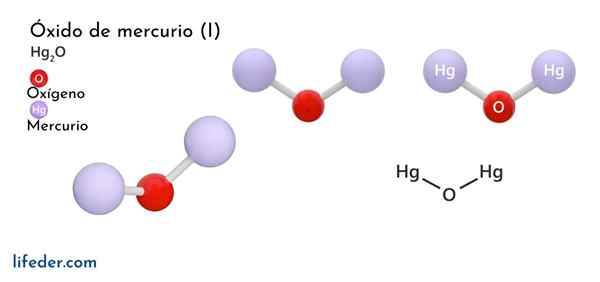
Oxyde de mercure (HG2O)
- 4626
- 1488
- Paul Dumas
Qu'est-ce que l'oxyde de mercure?
Il Oxyde de mercure (I) u oxyde ferrique, dont la formule chimique est représentée comme Hg2Ou, c'est un composé de phase solide, considéré comme toxique et instable du point de vue chimique, se transformant en mercure en sa forme élémentaire et à l'oxyde de mercure (II).
Il n'y a que deux espèces chimiques qui peuvent former du mercure lorsqu'elles sont combinées avec de l'oxygène, car ce métal a deux états d'oxydation uniquement (Hg+ et hg2+): Oxyde de mercure (i) et oxyde de mercure (II). L'oxyde de mercure (II) est dans un état d'agrégation solide, obtenant en deux formes cristallines relativement stables.
Ce composé est également connu simplement sous le nom d'oxyde de mercure, donc seule cette espèce sera traitée ici. Une réaction très courante qui se produit avec cette substance est que, lorsqu'il est soumis au réchauffement, sa décomposition se produit, produisant du mercure et de l'oxygène gazeux dans un processus endotherme.
Structure chimique
Dans des conditions de pression atmosphérique, cette espèce est présentée sous deux formes cristallines: un cinabrio si appelé et un autre connu sous le nom de Montrodite, qui est très rare. Les deux formes sont transformées en tétragonistes au-dessus de 10 GPa de pression.
La structure du cinabrio est basée sur des cellules hexagonales primitives (HP6) avec une symétrie trigonale, dont l'axe hélicoïdal est orienté vers la gauche (P32vingt-et-un); D'un autre côté, la structure de la Montrodite est orthique, basée sur une grille primitive qui forme des plans de glissement perpendiculaire aux trois axes (PNMA).
En revanche, deux formes d'oxyde de mercure peuvent être distinguées visuellement, car l'une est rouge et l'autre jaune. Cette distinction de couleur se produit grâce aux dimensions de la particule, car les deux formes ont la même structure.
Il peut vous servir: circonium: histoire, propriétés, structure, risques, utilisationsPour produire la forme rouge de l'oxyde de mercure, chauffage métallique au mercure dans l'oxygène à une température d'environ 350 ° C, ou au processus de pyrolyse de nitrate de mercure (II) (Hg (non3)2).
De la même manière, pour produire la forme jaune de cet oxyde2+ sous forme aqueuse avec une base.
Propriétés d'oxyde de mercure
- Il a un point de fusion d'environ 500 ° C (équivalent à 773 K), au-dessus de lequel il souffre de décomposition, et une masse molaire ou un poids moléculaire de 216,59 g / mol.
- Il est dans un état d'agrégation solide dans différentes couleurs: orange, rouge ou jaune, selon le degré de dispersion.
- C'est un oxyde de nature inorganique, dont la proportion avec l'oxygène est de 1: 1, ce qui en fait une espèce binaire.
- Il est considéré comme insoluble dans l'ammoniac, l'acétone, l'éther et l'alcool, ainsi que dans d'autres natures organiques.
- Sa solubilité dans l'eau est très faible, étant d'environ 0,0053 g / 100 ml à température standard (25 ° C) et augmentant avec l'augmentation de la température.
- Il est considéré comme soluble dans la plupart des acides; Cependant, la forme jaune montre une réactivité et une plus grande capacité de dissolution.
- Lorsque l'oxyde de mercure est exposé à la décomposition, tandis que sa forme rouge le fait lorsqu'il est exposé à des sources lumineuses.
- En étant soumis à un chauffage à la température dans laquelle il se décompose, il libère des gaz de mercure à forte toxicité.
- Ce n'est que lorsqu'il est chauffé jusqu'à 300-350 ° C, le mercure peut être combiné avec de l'oxygène à un rythme rentable.
Peut vous servir: suspensions chimiquesUtilisations / applications
Il est utilisé comme précurseur dans l'obtention du mercure élémentaire, car il subit des processus de décomposition de manière assez facile; À son tour, lors de sa décomposition, il produit de l'oxygène sous sa forme de soda.
De même, cet oxyde de nature inorganique est utilisé comme agent de naissance de valeur de type standard pour les espèces anioniques, car un composé est généré qui a une plus grande stabilité que sa forme initiale.
En ce sens, l'oxyde de mercure subit une dissolution lorsqu'il se trouve dans des solutions concentrées d'espèces de base, produisant des composés appelés hydroxocomplexes.
Ces composés sont complexes avec la structure mX(OH)et, où m représente un atome métallique et les indices x y y représentent le nombre de fois où les espèces se trouvent dans la molécule. Ils sont d'une utilité énorme dans les recherches chimiques.
De plus, l'oxyde de mercure (II) peut être utilisé dans les laboratoires pour la production de différents sels métalliques; Par exemple, l'acétate de mercure (II), qui est utilisé dans les processus de synthèse organique.
Ce composé est également utilisé, lorsqu'il est mélangé avec du graphite, comme matériau pour l'électrode cathodique dans la production de batteries au mercure et les cellules de type électricité et d'oxyde de zinc.
Des risques
- Cette substance, qui manifeste les caractéristiques de base d'une manière très faible, est un réactif très utile pour diverses applications telles que celles mentionnées ci-dessus, mais présente à son tour des risques importants pour l'être humain lorsqu'il est exposé à cela.
- L'oxyde de mercure a une toxicité élevée, pouvoir être absorbé par les voies respiratoires, car elle dégage des gaz irritants lorsqu'il est sous forme d'aérosol, en plus d'être extrêmement toxique s'il est ingéré ou s'il est absorbé par la peau lorsque il entre en contact direct avec cela.
Peut vous servir: chiralité- Ce composé produit une irritation des yeux et peut endommager les reins qui dérivent par la suite des problèmes d'insuffisance rénale.
- Lorsqu'il est consommé d'une manière ou d'une autre par les espèces aquatiques, ce produit chimique est des bioacumula dans ces derniers et affecte l'organisme des êtres humains qui les consomment régulièrement.
- Le chauffage de l'oxyde de mercure provient des vapeurs de mercure qui ont une toxicité élevée en plus de l'oxygène du gaz, augmentant ainsi le risque d'inflammabilité; c'est-à-dire pour produire des incendies et améliorer la combustion dans ces.
- Cet oxyde inorganique a un comportement oxydant puissant, il produit donc des réactions violentes lorsqu'elle entre en contact avec les agents réducteurs et certaines substances chimiques telles que le chlorure de soufre (CL2S2), peroxyde d'hydrogène (h2SOIT2), chlore et magnésium (uniquement lorsqu'il est chauffé).