Structure d'oxyde de strontium (SRO), propriétés, applications

- 2556
- 24
- Adrien Remy
Nous expliquons quels oxyde de strontium, sa structure chimique, ses propriétés physiques et chimiques, les applications et les risques
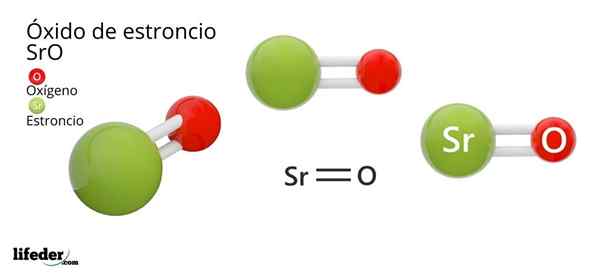
Il Oxyde de strontium, dont la formule chimique est SRO (à ne pas confondre avec le peroxyde de strontium, qui est SRO2), est le produit de la réaction oxydative entre ce métal et l'oxygène présent dans l'air à température ambiante: 2Sr (s) + O2 (g) → 2sro (s).
Un morceau de strontium brûle en contact avec l'air en raison de sa forte réactivité, et comme il a une configuration électronique du type NS2, ses deux électrons de valence donne facilement.
Si la surface du métal est augmentée en la pulvérisant jusqu'à ce qu'elle ait une poudre finement divisée, la réaction se produit immédiatement, et même brûlant avec une flamme rougeâtre intense. Strontium, métal qui participe à cette réaction, est un métal du groupe 2 du tableau périodique.
Ce groupe se compose des éléments appelés alcalins. Le premier des éléments dirigés par le groupe est le béryllium, suivi du magnésium, du calcium, du strontium, du baryum et enfin, la radio. Ces éléments sont de nature métallique et, en tant que règle mnémonique pour s'en souvenir, l'expression peut être utilisée: «Sr. Becambara ".
Le "MR" auquel l'expression se réfère n'est autre que le strontium métal Ses sels, nitrures et oxydes.
Pour cette raison, les minéraux et l'oxyde de strontium sont les composés dans lesquels le strontium se trouve dans la nature.
[TOC]
Propriétés physiques et chimiques de l'oxyde de strontium
 Aspect physique de l'oxyde de strontium
Aspect physique de l'oxyde de strontium L'oxyde de strontium est un composé blanc solide, poreux et toilettes et, selon son traitement physique, se trouve sur le marché comme une poussière fine, comme les cristaux ou les nanoparticules.
Peut vous servir: oxydesSon poids moléculaire est de 103 619 g / mol et a un indice de réfraction élevé. Il a des points de fusion (2531 ºC) et l'ébullition (3200 ° C), ce qui se traduit par de fortes interactions de liaison entre le strontium et l'oxygène. Ce point de fusion élevé en fait un matériau thermiquement stable.
Oxyde de base
C'est un oxyde hautement basique; Cela signifie qu'il réagit à température ambiante avec de l'eau pour former l'hydroxyde de strontium (SR (OH) 2):
SRO (S) + H2O (L) → SR (OH) 2
Solubilité
Il réagit ou conserve également l'humidité, caractéristique essentielle des composés hygroscopiques. Par conséquent, l'oxyde de strontium a une réactivité élevée avec l'eau.
Dans d'autres solvants - par exemple, les alcools tels que l'éthanol de la pharmacie ou du méthanol - sont légèrement solubles; Alors que dans des solvants tels que l'acétone, l'éther ou le dichlorométhane, il est insoluble.
Pourquoi est-ce comme ça? Parce que les oxydes métalliques - et encore plus ceux formés à partir de métaux alcalinotherres - sont des composés polaires et interagissent donc dans une meilleure mesure avec les solvants polaires.
Non seulement il peut réagir avec l'eau, mais aussi avec du dioxyde de carbone, produisant du carbonate de strontium:
SRO (S) + CO2 (G) → SRCO3 (S)
Il réagit avec les acides - comme par exemple, l'acide phosphorique dilué - pour produire le sel et l'eau de phosphate de sel:
3SRO (S) + 2 H3PO4 (DIL) → SR3 (PO4) 2 (S) + 3H2O (G)
Ces réactions sont exothermiques, c'est pourquoi l'eau produite est évaporée par des températures élevées.
Structure chimique
La structure chimique d'un composé explique à quoi ressemblent ses atomes dans l'espace. Dans le cas de l'oxyde de strontium, il présente une structure cristalline de type de sel de gemm, la même table du sel ou du chlorure de sodium (NaCl).
Peut vous servir: bicarbonate de calciumContrairement au NaCl, le sel monovalent - c'est-à-dire avec les cations et les anions d'une ampleur de charge (+1 pour Na et -1 pour le Cl) -, le SRO est divalent, avec 2+ charges pour le SR, et à partir de -2 pour O (O2-, anion oxyde).
Dans cette structure, chaque ion O2- (rouge) est entouré de six autres oxydes volumineux, hébergeant dans ses interstices octaédriques résultants les ions Sr2 + (couleur verte), plus petite. Cet emballage ou arrangement est connu sous le nom de cellule unitaire cubique centrée sur les faces (CCC).
Type de liaison
La formule chimique de l'oxyde de strontium est SRO, mais n'explique pas absolument la structure chimique ou le type de liaison existant.
Dans la section précédente, il a été mentionné qu'il présente une structure de sel GEMA; c'est-à-dire une structure cristalline très courante pour de nombreux sels.
Par conséquent, le type de lien est principalement ionique, ce qui clarifierait pourquoi cet oxyde a des points de fusion et d'ébullition élevés.
Comme le lien est ionique, ce sont les interactions électrostatiques qui maintiennent ensemble les atomes de strontium et d'oxygène: SR2 + O2-.
Si cette liaison était covalente, le composé pourrait être représenté avec des liens dans sa structure Lewis (omettant les électrons d'oxygène non partagés).
Applications
Les propriétés physiques d'un composé sont essentielles pour prédire quelles seraient leurs applications potentielles dans l'industrie; Par conséquent, ce sont un macro reflet de ses propriétés chimiques.
Substitut de plomb
L'oxyde de strontium, grâce à sa stabilité thermique élevée, trouve de nombreuses applications dans les industries de la céramique, du verre et de l'optique.
Son utilisation dans ces industries est principalement destinée à remplacer le plomb et être un additif qui confère de meilleures couleurs et viscosités à la matière première des produits.
Peut vous servir: louer des halogénuros: propriétés, obtenir, exemplesQuels produits? La liste n'aurait aucune fin, car dans aucun de ces personnes qui a du verre, des émaux, de la céramique ou des cristaux dans l'une de ses pièces, l'oxyde de strontium peut être utile.
Industrie aérospaciale
Comme il s'agit d'un solide très poreux, il peut intervenir de petites particules, et ainsi fournir une gamme de possibilités dans la formulation de matériaux, aussi léger que de l'industrie aérospatiale.
Catalyseur
Cette même porosité vous permet d'avoir des utilisations potentielles comme catalyseur (accélérateur de réactions chimiques) et comme échangeur de chaleur.
Des fins électroniques
L'oxyde de strontium sert également de source de production de Strban pur à des fins électroniques, grâce à la capacité de ce métal à absorber les rayons x; Et pour la préparation industrielle de son hydroxyde, Sr (OH) 2, et de son peroxyde, SRO2.
Risques pour la santé
C'est un composé corrosif, il peut donc provoquer des brûlures avec un contact physique simple n'importe où dans le corps. Il est très sensible à l'humidité et doit être stocké dans des espaces secs et froids.
Le produit de sels de la réaction de cet oxyde avec différents acides se comporte dans le corps ainsi que les sels de calcium, et sont stockés ou expulsés par des mécanismes similaires.
À l'époque, l'oxyde de strontium en soi ne représente pas de plus grands risques pour la santé.
Les références
- Éléments américains. (1998-2018). Éléments américains. Récupéré des Américains.com
- Fhiver & Atkins. (2008). CHIMIE INORGANIQUE. Dans les structures de solides simples (quatrième ed., p. 84). Mc Graw Hill.
- ATSDR. Récupéré de ASDR: ATSDR.CDC.Gouvernement
- Clark, J. (2009). Chemguide. Récupéré de Chemguide.co.ROYAUME-UNI
- Tiwary, r., Narayan, s., & Pandey, ou. (2007). Préparation de l'oxyde de stontium à partir de céleste: une revue. Science des matériaux, 201-211.

