Structure d'oxyde d'étain (II), propriétés, nomenclature, utilisations

- 5112
- 1098
- Adrien Remy
Il oxyde d'étain (II) Il s'agit d'un solide inorganique cristallin qui est formé par oxydation de l'étain (Sn) par l'oxygène, où l'étain acquiert Valence 2+. Sa formule chimique est SNO. Deux façons différentes de ce composé sont connues: le noir et le rouge. La forme commune et la plus stable à température ambiante est une modification noire ou bleu noir.
Cette forme est préparée par hydrolyse du chlorure d'étain (II) (SNCL2) En solution aqueuse, à laquelle un hydroxyde d'ammonium est ajouté (NH4Oh) pour obtenir un précipité d'oxyde hydraté de Sn (II) dont la formule est SNO.Xh2Ou, où x<1 (x menor que 1).
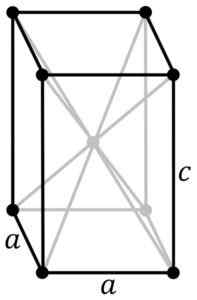 Structure cristalline tétragonale du SNO bleu noir. L'atome SN est situé au centre de la structure et des atomes d'oxygène dans les sommets du parallélépipant. PNGS d'origine par l'utilisateur: Rocha, tracé dans Inkscape par l'utilisateur: Stannered [CC BY-SA 3.0 (http: // CreativeCommons.Org / licences / by-sa / 3.0 /]] Source: Wikipedia Commons
Structure cristalline tétragonale du SNO bleu noir. L'atome SN est situé au centre de la structure et des atomes d'oxygène dans les sommets du parallélépipant. PNGS d'origine par l'utilisateur: Rocha, tracé dans Inkscape par l'utilisateur: Stannered [CC BY-SA 3.0 (http: // CreativeCommons.Org / licences / by-sa / 3.0 /]] Source: Wikipedia Commons L'oxyde hydraté est un solide amorphe blanc, qui est ensuite chauffé en suspension à 60-70 ºC pendant plusieurs heures en présence de NH4Oh, jusqu'à ce que vous obteniez le sno pur cristallin noir.
La forme rouge du SNO est métastable. Il peut être préparé en ajoutant de l'acide phosphorique (h3Pote4) - Avec 22% d'acide phosphoreux, H3Pote3 - Et puis NH4Oh une solution SNCL2. Le solide blanc obtenu est chauffé dans la même solution à 90-100 ºC pendant environ 10 minutes. De cette façon, le SNO cristallin rouge pur est obtenu.
L'oxyde d'étain (II) est un matériau de départ pour la production d'autres composés d'étain (II). Pour cette raison, c'est l'un des composés de l'étain qui a une importance commerciale appréciable.
L'oxyde d'étain (II) présente une faible toxicité comme avec la plupart des composés inorganiques de l'étain. Cela est dû à leur mauvaise absorption et à leur excrétion rapide des tissus des êtres vivants.
Il peut vous servir: Bipe Beraral: Qu'est-ce que les caractéristiques, à quoi sertPrésente l'une des plus grandes tolérances de composés d'étain dans les tests effectués avec des rats. Cependant, il peut être nocif s'il est inhalé en grande quantité.
[TOC]
Structure
Oxyde d'étain (ii) bleu noir
Cette modification se cristallise avec une structure tétragonale. Il a un arrangement de couche.
D'autres chercheurs affirment que chaque atome de SN est entouré de 5 atomes d'oxygène qui sont approximativement dans les sommets d'un octaèdre, où le sixième sommet est probablement occupé par une paire d'électrons libres ou non appariés. Ceci est connu comme la disposition φ-octique.
Oxyde d'étain rouge (II)
Cette forme d'oxyde d'étain (II) cristallise avec une structure orthique.
Nomenclature
- Oxyde d'étain (II)
- Estany oxyde
- Monoxyde d'étain
- Estany oxyde
Propriétés
État physique
Solide cristallin.
Poids moléculaire
134,71 g / mol.
Point de fusion
1080 ºC. Il se décompose.
Densité
6,45 g / cm3
Solubilité
Insoluble dans l'eau froide ou chaude. Insoluble dans le méthanol, mais il se dissout rapidement dans les acides et les alcalis concentrés.
Autres propriétés
Si plus de 300 ºC est chauffé en présence d'air, l'oxyde d'étain (II) est rapidement oxydé dans l'oxyde d'étain (IV) présentant l'inclandescence.
Il a été rapporté que dans des conditions non oxydantes, le chauffage d'oxyde d'étain (II) a divers résultats en fonction du degré de pureté de l'oxyde de départ. Il est généralement disproportionné dans le SN métallique et l'oxyde d'étain (IV), SNO2, Avec diverses espèces intermédiaires qui deviennent finalement SNO2.
L'oxyde d'étain (II) est amphotéro, car il est dissous dans les acides pour donner des ions SN2+ ou des complexes d'anions, et se dissout également dans des alcalis pour former des solutions d'ions stanning hydroxy, SN (OH)3-, qui ont une structure pyramidale.
Il peut vous servir: acide perchlorique: formule, caractéristiques et utilisationsDe plus, le SNO est un agent réducteur et réagit rapidement avec les acides organiques et les minéraux.
Il présente une faible toxicité par rapport aux autres sels d'étain. Son DL50 (dose létale à 50% ou dose mortelle moyenne) chez le rat est de plus de 10000 mg / kg. Cela signifie que plus de 10 grammes par kilogramme sont nécessaires pour tuer 50% des échantillons de rat dans une certaine période d'essai. En comparaison, Tin Fluorure (II) présente un DL50 de 188 mg / kg.
Cependant, s'il est inhalé pendant longtemps, il est déposé dans les poumons car il n'est pas absorbé et peut produire de l'étain (infiltration de la poussière SNO dans les interstices pulmonaires).
Applications
Dans la production d'autres composés d'étain (II)
Sa réaction rapide avec les acides est la base de son utilisation la plus importante, qui est en tant qu'intermédiaire dans la fabrication d'autres composés en étain.
Il est utilisé dans la production de bromure d'étain (II) (SNBR2), Du cyanure d'étain (II) (Sn (CN)2) et l'hydrate de fluorobore d'étain (II) (SN (bf4)2), Entre autres composés d'étain (II).
Le fluoroborate d'étain (II) est préparé en dissolvant Snam. Cela est dû, entre autres, à sa capacité de couverture élevée.
L'oxyde d'étain est également utilisé dans la préparation du sulfate d'étain (II) (SNSO4), par SNO et réaction d'acide sulfurique, H2Swin4.
Le SNSO4 Obtenu, il est utilisé dans le processus en conserve pour la production de plaques de circuit imprimées, pour la finition de contact électrique et pour les ustensiles de cuisine.
Peut vous servir: carbonate d'aluminium: structure, propriétés, utilisations Circuit imprimé. Aucun auteur lisible par machine fourni. Abraham del Pozo a supposé (sur la base des réclamations du droit d'auteur). [Domaine public] Source: Wikimedia Commons
Circuit imprimé. Aucun auteur lisible par machine fourni. Abraham del Pozo a supposé (sur la base des réclamations du droit d'auteur). [Domaine public] Source: Wikimedia Commons La forme hydratée du SNO, la Tin Hydrotado (II) SNO.Xh2Ou, il est traité avec de l'acide fluorhorhorique pour obtenir du fluorure d'étain (II), SNF2, qui est ajouté aux crèmes dentifriques en tant qu'agent pour lutter contre les caries.
En bijoux
L'oxyde d'étain (II) est utilisé dans la préparation des cristaux d'étirement d'or et de cuivre. Apparemment, sa fonction dans cette application est d'agir comme un agent réducteur.
 Bijou avec rubis. Source: Pixabay
Bijou avec rubis. Source: Pixabay Autres utilisations
Il a été utilisé dans des dispositifs photovoltaïques pour la production d'électricité à partir de la lumière, comme les cellules solaires.
 Appareil photovoltaïque. Georg Slickers [CC BY-SA 2.5 (https: // CreativeCommons.Org / licences / by-sa / 2.5)] Source: Wikipedia Commons
Appareil photovoltaïque. Georg Slickers [CC BY-SA 2.5 (https: // CreativeCommons.Org / licences / by-sa / 2.5)] Source: Wikipedia Commons Innovations récentes
Des nanoparticules de sno-ordonnées ont été utilisées dans les électrodes de nanotubes de carbone pour les batteries au lithium-sucre.
 Nanofibres hydrates SNO. Fionán [cc by-sa 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] Source: Wikipedia Commons
Nanofibres hydrates SNO. Fionán [cc by-sa 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] Source: Wikipedia Commons Les électrodes SNO préparées présentent une conductivité élevée et peu de changement de volume dans les cycles de chargement et de téléchargement répétitifs.
De plus, le SNO facilite un transfert rapide d'ions / électrons lors des réactions d'oxydation-réduction qui se produisent dans le système de batteries.
Les références
- Coton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley & Sons.
- Danse, j.C.; Emeléus, h.J.; Sir Ronald Nyholm et Trotman-Deckenson, à.F. (1973). Chimie inorganique complète. 2ieme volume. Presse à pergamon.
- Encyclopédie de la chimie industrielle d'Ullmann. (1990). CINQUIÈME ÉDITION. Volume A27. VCH VERLAGSGELLSCHAFT MBH.
- Kirk-othmer (1994). Encyclopédie de la technologie chimique. Volume 24. Quatrième édition. John Wiley & Sons.
- Ostrakhovitch, Elena à. Et cherian, m. George. (2007). Étain. Dans Handbook of the Toxicology of Metals. Troisième édition. Récupéré de ScienceDirect.com.
- Kwestroo, w. et vromans, p.H.g.M. (1967). Préparation de trois modifications de l'oxyde d'étain pur (II). J. Inorg. Nucl. Chem., 1967, vol.29, pp.2187-2190.
- Foud, s.S et al. (1992). Propriétés optiques des films minces d'oxyde stanneux. Journal tchèque de physique. Février 1992, volume 42, numéro 2. Récupéré de Springer.com.
- A-young Kim et al. (2017). Nanoparticules SNO ordonnées dans MWCNT en tant que matériau hôte fonctionnel pour la batterie au lithium-sulfur à haut débit Cathode. Nano Research 2017, 10 (6). Récupéré de Springer.com.
- Bibliothèque nationale de médecine. (2019). Oxyde stanique. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- « Jacquard Loom History, opération, utilise
- Fonctionnalisme (architecture) Histoire, caractéristiques, œuvres »

