Voltampérométrie
- 2456
- 589
- Anaïs Julien
 La voltampérométrie est une méthode électrochimique qui mesure le courant d'une électrode
La voltampérométrie est une méthode électrochimique qui mesure le courant d'une électrode Qu'est-ce que la voltampérométrie?
La voltampérométrie Il s'agit d'une technique électroanalytique qui détermine les informations d'une espèce chimique ou analyte des courants électriques générés par la variation d'un potentiel appliqué. C'est-à-dire que le potentiel e (v) appliqué, et le temps (t), sont les variables indépendantes; Tandis que le courant (a), la variable dépendante.
Les espèces chimiques devraient normalement être électroactives. Cela signifie qu'il doit perdre (oxyder) ou gagner (réduire) les électrons. Pour que la réaction commence, l'électrode de travail doit fournir le potentiel nécessaire théoriquement par l'équation de Nernst.
Cette méthode est largement utilisée dans les processus inorganiques, biochimiques et physiques, en particulier pour analyser les processus d'oxydation, de réduction ou d'adsorption, entre autres.
Comment fonctionne la voltampérométrie?
La voltampérométrie a été développée grâce à l'invention du prix Nobel Nobel Nobel de 1922, Jaroslav Heyrovsky (1890-1967). Dans ce document, l'électrode de dépôt de mercure (EGM) est constamment renouvelée et polarisée.
Les carences analytiques de cette méthode à l'époque ont été résolues avec l'utilisation et la conception d'autres microélectrodes. Ceux-ci varient considérablement du matériau, du charbon, des métaux nobles, du diamant et des polymères, même dans sa conception, ses disques, les cylindres, les feuilles; Et en plus, dans la façon dont ils interagissent avec la solution: stationnaire ou rotatif.
Tous ces détails sont destinés1). Ceci est proportionnel à la concentration de l'analyte et à la moitié du pouvoir e (e (e1/2) pour atteindre la moitié de ce courant (i1/2) est caractéristique de l'espèce.
Donc, déterminer les valeurs de e1/2 Dans la courbe où le courant obtenu avec la variation de E est graphique, appelé voltamperogramme, La présence d'un analyte peut être identifiée. C'est-à-dire que chaque analyte, compte tenu des conditions de l'expérience, aura sa propre valeur de e1/2.
Peut vous servir: point d'équivalenceOnde voltampérométrique
En voltampérométrie, nous travaillons avec de nombreux graphiques. Le premier est la courbe e vs. T, qui vous permet de surveiller les différences potentielles appliquées en fonction du temps.
Mais en même temps, le circuit électrique enregistre les valeurs C produites par l'analyte lors de la perte ou de la prise d'électrons à proximité de l'électrode.
Parce que l'électrode est polarisée, moins d'analyte peut être réparti à partir du sein de la solution. Par exemple, si l'électrode a une charge positive, espèce x- Il sera attiré par cela et le conduira pour une simple attraction électrostatique.
Mais x- n'est pas seul: il y a d'autres ions présents dans votre environnement. Certains cations m+ Ils peuvent entraver leur chemin vers l'électrode en le localisant en «grappes» de charges positives; Et aussi, anions n- Ils peuvent être volés autour de l'électrode et empêcher x- Je viens à lui.
La somme de ces phénomènes physiques entraîne la perte de courant, et cela est observé dans le C VS. E et sa forme similaire à celle d'un s, appelé forme sigmoïde. Cette courbe est connue sous le nom d'onde voltampérométrique.
Instrumentation
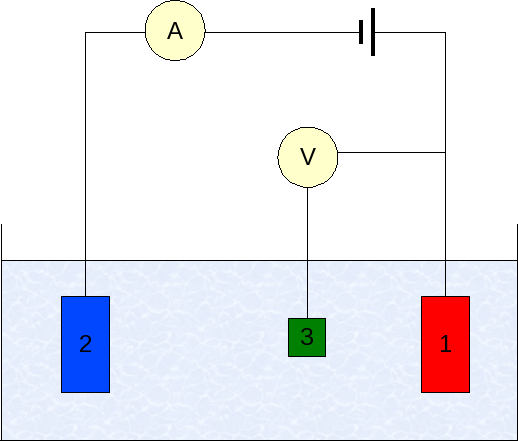 Électrodes en voltampérométrie. Source: Wikimedia Commons
Électrodes en voltampérométrie. Source: Wikimedia Commons L'instrumentation de la voltampérométrie varie selon l'analyte, le solvant, le type d'électrode et l'application. Mais, la grande majorité d'entre eux sont basés sur un système composé de trois électrodes: l'un des travaux (1), auxiliaire (2) et la référence (3).
L'électrode de référence principale utilisée est l'électrode Calomenanos (ECS). Ceci, avec l'électrode de travail, permet d'établir une différence de potentiel ΔE, car le potentiel de l'électrode de référence reste constant pendant les mesures.
Peut vous servir: sélénium: histoire, propriétés, structure, obtention, utilisationsD'un autre côté, l'électrode auxiliaire est responsable du contrôle de la charge qui passe à l'électrode de travail, afin de le maintenir dans les valeurs acceptables. La variable indépendante, la différence de potentiel appliquée, est celle obtenue par la somme des potentiels des électrodes de travail et la référence.
Types de voltampérométrie
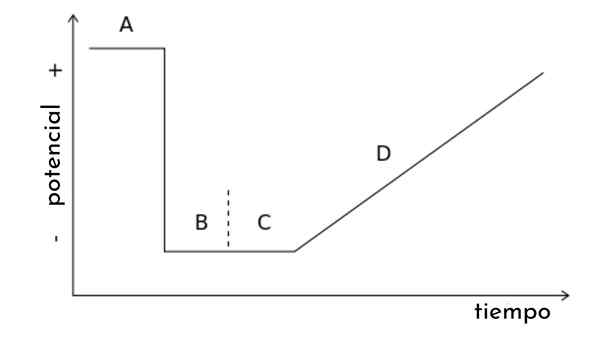
Dans l'image de l'article, un graphique est affiché. t, également appelé onde potentielle pour la voltampérométrie de balayage linéaire.
On peut voir que le temps passe, le potentiel augmente. À son tour, ce balayage génère une courbe de réponse, ou voltamperogramme C vs. E, dont la forme sera sigmoïde. Un point viendra où, quelle que soit la façon dont il augmente, il n'y aura pas d'augmentation du courant.
D'autres types de voltampérométrie peuvent être déduits de ce graphique, modifiant l'onde potentielle. t par des impulsions potentielles soudaines suivant certains modèles. Chaque modèle est associé à un type de voltampérométrie et englobe sa propre théorie et conditions expérimentales.
Voltampérométrie d'impulsion
Dans ce type de voltampérométrie, vous pouvez analyser des mélanges de deux analytes ou plus dont e e1/2 sont très proches les uns des autres.
Ainsi, un analyte avec e1/2 de 0.04v peut être identifié en compagnie d'un autre avec un e1/2 de 0.05v. En cas de voltampérométrie de balayage linéaire, la différence doit être supérieure à 0.2V.
Par conséquent, il y a une plus grande sensibilité et des limites de détection plus faibles; c'est-à-dire que les analytes peuvent être déterminés à de très faibles concentrations.
Les vagues potentielles peuvent avoir des modèles similaires pour les escaliers, les escaliers inclinés et les triangles. Ce dernier correspond à la voltampérométrie cyclique (CV).
Peut vous servir: réactif limitant et excessifDans le CV, un potentiel et s'applique dans un sens, positif ou négatif, puis, à une certaine valeur de E à une époque, le même potentiel mais dans le sens opposé est ré-appliqué. Lors de l'étude des voltampeogrammes générés, les maximums révèlent la présence d'intermédiaires dans une réaction chimique.
Voltampérométrie de redisolution
Cela peut être de type anodique ou cathodique. Il se compose de l'électrodéposition de l'analyte sur une électrode au mercure. Si l'analyte est un ion métallique (comme le CD2+), un amalgame sera formé; Et si c'est un anion (comme moo42-), un sel de mercure insoluble.
Ensuite, des impulsions potentielles sont appliquées pour déterminer la concentration et l'identité des espèces d'électrodepos. Ainsi, l'amalgame est redisugu, tout comme les sels de mercure.
Applications de voltamperométrie
- La voltampérométrie de redisolution anodique est utilisée pour déterminer la concentration de métaux dissolus fluides.
- Il permet d'étudier la cinétique des processus redox ou d'adsorption, en particulier lorsque les électrodes sont modifiées pour détecter un analyte spécifique.
- Sa base théorique a servi à la fabrication de biocapteurs. Avec ceux-ci, la présence et la concentration de molécules biologiques, de protéines, de graisses, de sucres, etc. peuvent être déterminées.
- Enfin, il détecte la participation des intermédiaires aux mécanismes de réaction.
Les références
- González M. (2010). Voltampérométrie. Récupéré de: chimie.Laguia2000.com
- Chemistry and Science (2011). Voltampérométrie. Récupéré de: Thequimica andlaciencia.Blogspot.com
- Quiroga a. (2017). Voltamétrie cyclique. Récupéré de: Chem.Bibliothèque.org
- Samuel P. Kouves (s.F.). Techniques voltampérométriques. [PDF]. Université Tufts. Récupéré de: brun.Édu
- Jour r. & Underwood A. Chimie analytique quantitative (Fifth Ed.). Pearson Prentice Hall.

