Volatilisation

- 1409
- 273
- Mlle Ambre Dumont
 Lorsque l'eau est chauffée dans une plaque jusqu'à ce que la vapeur se produise, la volatilisation se produit. Avec licence
Lorsque l'eau est chauffée dans une plaque jusqu'à ce que la vapeur se produise, la volatilisation se produit. Avec licence Qu'est-ce que la volatilisation?
La volatilisation C'est le processus de conversion d'un produit chimique d'un liquide ou d'un état solide en un gazeux ou à la vapeur. Les autres termes utilisés pour décrire le même processus sont la vaporisation, la distillation et la sublimation.
Une substance peut souvent être séparée d'une autre par volatilisation et peut être récupérée par condensation à la vapeur.
La substance peut être volatilisée plus rapidement, soit la chauffant pour augmenter sa pression de vapeur ou par la vapeur, en utilisant un flux de gaz inerte ou une pompe à vide.
Les procédures de chauffage comprennent la volatilisation de l'eau, du mercure ou du trichlorure d'arsenic pour séparer ces substances des éléments interférentiels.
Parfois, des réactions chimiques sont utilisées pour produire des produits volatils, comme dans la libération de dioxyde de carbone à partir de carbonates, l'ammoniac dans la méthode de Kjeldahl pour la détermination de l'azote et du dioxyde de soufre dans la détermination du soufre d'acier.
Les méthodes de volatilisation sont généralement caractérisées par une grande simplicité et une facilité de fonctionnement, sauf lorsqu'ils sont très résistants aux résistants à la corrosion ou que les matériaux sont nécessaires.
Volatilisation de la pression de vapeur
Sachant que la température bouillante de l'eau est à 100 ° C, il est pertinent de se demander pourquoi l'eau de pluie s'évapore. Si c'est à 100 ° C, cela devrait nous donner de la chaleur.
Il vaut également la peine de demander ce que l'arôme caractéristique donne à l'alcool, au vinaigre, au bois ou au plastique.
La personne responsable de tout cela est une propriété connue sous le nom de pression de vapeur, qui est la pression exercée par une vapeur en équilibre avec la phase solide ou liquide de la même substance. De plus, la pression partielle de la substance dans l'atmosphère sur le solide ou le liquide.
La pression de vapeur est une mesure de la tendance d'un matériau à changer à l'état gazeux ou à la vapeur, c'est-à-dire une mesure de la volatilité des substances.
Il peut vous servir: disulfure de carbone (CS2): structure, propriétés, utilisations, risquesÀ mesure que la pression de vapeur augmente, plus la capacité du liquide ou du solide à s'évaporer, étant ainsi plus volatile.
La pression de vapeur augmentera avec la température. La température à laquelle la pression de vapeur sur la surface d'un liquide est égale à la pression exercée par l'environnement est appelée point d'ébullition liquide.
La pression de vapeur dépendra du soluté dissous en solution (c'est une propriété coligative). À la surface de la solution (interface à faiblesse), les molécules les plus superficielles ont tendance à s'évaporer, en échangeant entre les phases et en générant une pression de vapeur.
La présence de soluté diminue le nombre de molécules de solvant à l'interface, réduisant la pression de vapeur.
Le changement de pression de vapeur peut être calculé avec la loi de Raault pour les solutés non volatils, qui est donné par:
(1)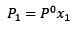 Lorsque P1 est la pression de vapeur après avoir ajouté le soluté, X1 est la fraction molaire dudit soluté et P ° est la pression de vapeur du solvant pur.
Lorsque P1 est la pression de vapeur après avoir ajouté le soluté, X1 est la fraction molaire dudit soluté et P ° est la pression de vapeur du solvant pur.
Si la somme des fractions molaires du soluté et du solvant est égale à 1, alors nous avons:
(2)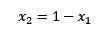
Où x2 est la fraction molaire du solvant. Si nous multiplions les deux côtés de l'équation par P °, il reste:
(3)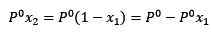
Le remplacement (1) dans (3) reste:
(4)
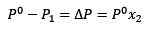
C'est la variation de la pression de vapeur lorsqu'un soluté se dissout.
Analyse gravimétrique
L'analyse gravimétrique est une classe de techniques de laboratoire utilisées pour déterminer la masse ou la concentration d'une substance en mesurant un changement de masse.
Le chimiste que nous essayons de quantifier est parfois appelé analyte. Nous pourrions utiliser l'analyse gravimétrique pour répondre à des questions telles que:
Peut vous servir: minéraux métalliques- Quelle est la concentration de l'analyte dans une solution?
- À quel point notre échantillon est-il pur? L'échantillon ici pourrait être solide ou en solution.
Il existe deux types communs d'analyse gravimétrique. Les deux impliquent le changement de phase d'analyte pour le séparer du reste d'un mélange, donnant lieu à un changement de pâte.
L'une de ces méthodes est la gravimétrie des précipitations, mais celle qui nous intéresse vraiment est la volatilisation de la gravimétrie.
La gravimétrie de volatilisation est basée sur thermique ou chimiquement l'échantillon et mesure le changement résultant dans sa masse.
Alternativement, nous pouvons attraper et peser un produit volatil de la décomposition. Parce que la libération d'une espèce volatile est une partie essentielle de ces méthodes, nous les classons collectivement comme des méthodes d'analyse de volatilisation gravimétrique.
Les problèmes d'analyse gravimétrique sont simplement des problèmes de stoechiométrie avec quelques étapes supplémentaires.
Pour effectuer tout calcul stoechiométrique, nous avons besoin des coefficients de l'équation chimique équilibrée.
Par exemple, si un échantillon contient des impuretés de baryum dihydraté (BACL2● H₂o), vous pouvez obtenir la quantité d'impuretés chauffant l'échantillon pour évaporer l'eau.
La différence de masse entre l'échantillon d'origine et l'échantillon chauffé nous donnera, en grammes, la quantité d'eau contenue dans le chlorure de baryum.
Avec un calcul stoechiométrique simple, la quantité d'impuretés de l'échantillon sera obtenue.
Distillation fractionnée
La distillation fractionnaire est un processus par lequel les composants d'un mélange liquide sont séparés en différentes parties (appelées fractions) en fonction de leurs différents points d'ébullition.
La différence de volatilité des composés du mélange joue un rôle fondamental dans sa séparation.
Peut vous servir: règle d'octetLa distillation fractionnaire est utilisée pour purifier les produits chimiques et également pour séparer les mélanges et obtenir leurs composants. Il est utilisé comme technique de laboratoire et dans l'industrie, où le processus a une grande importance commerciale.
Les vapeurs d'une solution d'ébullition sont passées le long d'une colonne haute, appelée colonne de subdivision.
La colonne est remplie de perles en plastique ou en verre pour améliorer la séparation, offrant plus de surface pour la condensation et l'évaporation.
La température de la colonne diminue progressivement sur sa longueur. Les composants avec un point d'ébullition plus élevé sont condensés dans la colonne et retournent à la solution.
Les composants des points d'ébullition inférieurs (plus volatils) passent à travers la colonne et sont collectés près du haut.
Théoriquement, avoir plus de perles ou de plaques améliore la séparation, mais l'ajout de plaques augmente également le temps et l'énergie nécessaires pour terminer une distillation.
Exemples de volatilisation
- Un bloc de glace sec en contact avec une rafale d'air. L'air commence le processus de volatilisation et la glace s'évapore: elle passe de l'état solide vers le soda.
- Lorsque l'eau ou autre substance est bouillie: la chaleur génère de la vapeur, et donc l'eau passe de l'état liquide au gazeux.
- Les pilules de naphtaline, qui se dégradent et passent progressivement de l'état solide vers le soda.
- Lorsque le soufre solide est soumis à des températures élevées, elle devient des gaz toxiques. C'est-à-dire qu'il passe de solide à gazeux.
- Pilules aromatisant: ils ont le même processus que les pilules de naphtaline, se dégradent progressivement et deviennent du gaz, odorants et inoffensifs.
Les références
- Définition de pression Steam. Récupéré de Thoughtco.com.
- Pression de vapeur. Récupéré de Britannica.com.

