Caractéristiques de la troponine, structure, fonctions et tests
- 4754
- 405
- Louna Baron
Troponine C'est le nom qui reçoit une protéine présente dans le muscle squelettique et cardiaque des vertébrés, associée aux filaments dans les fibres musculaires et qui a des fonctions dans la régulation de l'activité contractile (contraction et relaxation musculaire).
Les fibres musculaires sont les cellules qui composent le tissu musculaire, dont la capacité de contraction est basée sur l'interaction entre les filaments qui sont ordonnés et étroitement associés à l'intérieur, occupant la majeure partie du volume cytoplasmique.
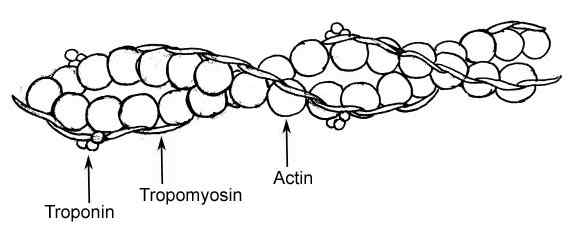 Représentation graphique des éléments d'un filament mince dans les fibres musculaires (source: Raul654, via Wikimedia Commons)
Représentation graphique des éléments d'un filament mince dans les fibres musculaires (source: Raul654, via Wikimedia Commons) Ces filaments sont connus sous le nom de myofilaments et il y a deux classes: l'épaisseur et mince. Les filaments épais sont composés de molécules de myosine II, tandis que les filaments minces sont des polymères globulaires d'actine ou d'actine G en association avec deux autres protéines.
L'actine et la myosine se trouvent également dans d'autres cellules du corps humain et d'autres organismes, uniquement dans une proportion beaucoup moins proportionnels et en participant à différents processus tels que la migration cellulaire, l'exocytose, dans la cytocinie (pendant la division cellulaire) et même dans le trafic vésiculaire intracellulaire.
La troponine et la tropomiosine sont les deux protéines associées à des filaments d'actine minces qui participent à la régulation des processus de contraction et de relaxation des myofibrilles des cellules musculaires ou des fibres.
Les mécanismes d'action par lesquels ces deux protéines exercent leur fonction sont liés à la concentration intracellulaire de calcium. Le système de régulation de la troponine est l'un des systèmes les plus connus de la physiologie et de la biochimie de la contraction des muscles squelettiques.
Ces protéines sont d'une grande importance pour le corps. À l'heure actuelle, on sait avec certitude que certaines cardiomyopathies familiales ou congénitales sont le produit de mutations dans la séquence des gènes pour lesquels ils codent pour (troponine ou tropomiosine).
[TOC]
Caractéristiques
La troponine est associée à l'actine des filaments minces de fibres musculaires dans le muscle squelettique et cardiaque dans un rapport stoechiométrique de 1 à 7, c'est-à-dire une molécule de troponine pour 7 molécules d'actine.
Cette protéine, comme stressée, se trouve exclusivement dans les filaments contenus à l'intérieur des myofibrilles des fibres musculaires striées squelettiques et cardiaques, et non dans les fibres musculaires lisses qui composent les muscles vasculaires et viscéraux.
Il est conçu par certains auteurs tels que la protéine régulatrice de la tropomiosine. Comme cela, il a des sites syndicaux pour l'interaction avec les molécules d'actine, ce qui lui donne la capacité de réguler son interaction avec la myosine de filaments épais.
Peut vous servir: Aldohexosa: structure moléculaire et exemplesDans les myofilaments, la relation entre la troponine et les molécules de tropomiosine est de 1 à 1, ce qui signifie que pour chaque complexe de troponine qui existe, il existe une molécule de tropomiosine associée à ce.
Structure
La troponine est un complexe de protéines composé de trois sous-unités globulaires différentes appelées troponine I, troponine C et troponine T, qui additionnent ensemble, plus ou moins, 78 kDa.
Dans le corps humain, il existe des variantes spécifiques aux tissus pour chacune de ces sous-unités, qui diffèrent les unes des autres au niveau génétique et moléculaire (par rapport aux gènes qui les codent), comme au niveau structurel (par rapport à leur acide aminé séquences).
 Représentation de l'une des sous-unités de la troponine (Source: Jawahar Swaminathan et MSD Staff au European Bioinformatics Institute [Domain public] via Wikimedia Commons)
Représentation de l'une des sous-unités de la troponine (Source: Jawahar Swaminathan et MSD Staff au European Bioinformatics Institute [Domain public] via Wikimedia Commons) La toponine C ou le TNC est la plus petite des trois sous-unités et peut-être l'une des plus importantes. Il a un poids moléculaire de 18 kDa et a des sites pour rejoindre le calcium (Ca2 +).
La troponine T ou TNT est celle qui a les sites syndicaux pour ancrer le complexe des trois sous-unités de la tropomiosine et a un poids moléculaire de 30 kDa; Il est également connu sous le nom de jonction de sous-unité ou de tropomiosine.
La troponine I ou le TNI, de un peu plus de 180 déchets d'acides aminés, a le même poids moléculaire que la troponine, mais dans sa structure, il a les sites spéciaux pour rejoindre l'actine, bloquant l'interaction entre cette dernière et la myosine, qui est le phénomène responsable Pour la contraction des fibres musculaires.
De nombreux manuels se réfèrent à cette sous-unité, comme la sous-unité inhibitrice et comme la "pâte" moléculaire entre les trois sous-unités de la troponine. Sa capacité à un syndicat à l'actine et à son activité inhibitrice sont améliorées par son association avec la tropomiosine, médiée par la sous-unité TNT.
Il a été démontré que, dans la sous-unité I, la région de la séquence en charge de l'inhibition est définie par un peptide central de 12 déchets d'acides aminés entre les positions 104 et 115; et que la région C-terminale de la sous-unité a également une fonction pendant l'inhibition.
Les fonctions
La fonction principale de la troponine dans la contraction musculaire dépend de sa capacité à rejoindre le calcium, car cette protéine est le seul composant des filaments minces dans le muscle strié que cette propriété a.
En l'absence de troponine, les filaments minces sont capables de rejoindre des filaments épais et des contrats, quelle que soit la concentration intracellulaire de calcium, de sorte que la fonction de la troponine est d'éviter la contraction en l'absence de calcium par son association avec la tropomiosine.
Peut vous servir: ovuliparosAinsi, la troponine joue un rôle important dans le maintien de la relaxation musculaire lorsqu'il n'y a pas assez de calcium intracellulaire et dans la contraction musculaire lorsque le stimulus électrique nerveux permet l'entrée de calcium dans la fibre musculaire.
Comment cela peut-il arriver?
Dans les muscles squelettiques et striés cardiaques, la contraction musculaire se produit grâce à l'interaction entre les filaments fins et épais qui se glissent sur.
Dans les cellules de ces muscles, le calcium est essentiel pour l'interaction agissant-mulosine (filaments minces et épais), car les sites syndicaux de l'actine pour la myosine sont «cachés» par l'action articulaire de la tropomiosine et de la troponine, qui répond » au calcium.
Les ions calcium provenant du réticulum sarcoplasmique (le réticulum endoplasmique des fibres musculaires) se lient à la sous-unité C de la troponine, qui neutralise l'inhibition médiée par la troponine et la contraction musculaire est déclenchée.
La «neutralisation» de l'inhibition causée par la sous-unité I se produit après l'union de calcium à la sous-unité C, qui génère un changement conformationnel qui se propage entre les trois sous-unités et permet sa dissociation des molécules d'actine et de la tropomiosine et de la tropomiosine.
Cette dissociation entre la troponine, la tropomiosine et l'actine expose dans l'actine les sites syndicaux de la myosine. C'est alors que les têtes globulaires de ce dernier peuvent interagir avec les fibres d'actine et initier la contraction dépendante de l'ATP en raison du déplacement d'un filament sur l'autre.
Test de troponine
La troponine est le biomarqueur préféré pour la détection des lésions cardiaques. Par conséquent, le test de troponine est largement utilisé dans le diagnostic biochimique, précoce et / ou préventif, de certaines conditions pathologiques cardiaques telles que l'infarctus aigu du myocarde.
De nombreux médecins traitants considèrent que ce test facilite la prise de décision en ce qui concerne ce qu'il faut faire et quel traitement pour administrer des patients souffrant de douleur thoracique.
En général, il est lié à la détection des sous-unités T et I de la troponine, car la troponine C isforma se trouve également dans les muscles squelettiques de contraction lente; c'est-à-dire qu'il n'est pas spécifique au cœur.
Quelle est la troponine basée sur le test?
Le test de troponine est généralement un essai immunitaire qui détecte des isoformes cardiaques de sous-unités T et I de la troponine. Ensuite, il est basé sur les différences qui existent entre les deux isoformes.
Peut vous servir: synthèse des protéinesIsoforme de la sous-unité de la toponine I (CTNI) (CTNI)
Dans le tissu musculaire du myocarde, il n'y a qu'une seule isoforme de la sous-unité I de la troponine, caractérisée par la présence d'une "queue" post-traductionnelle de 32 acides aminés à son extrémité N-terminale.
Cette isoforme est détectée grâce au développement d'anticorps monoclonaux spécifiques qui ne reconnaissent pas d'autres isoformes non cardiaques, car la queue d'acide aminé est plus ou moins 50% différente des extrémités des autres isoformes.
Le CTNI n'est pas exprimé dans les tissus endommagés, mais est exclusif pour le tissu cardiaque adulte.
Isoforme de la sous-unité de troponine T (CTNT) (CTNT)
L'isoforme cardiaque de la sous-unité t de la troponine est codée dans trois gènes différents, dont l'ARNM peut subir des coupes et des épisses alternatives qui entraînent la production d'isoformes avec des séquences variables aux extrémités n et c-terminales.
Bien que le muscle cardiaque des êtres humains contient 4 isoformes TNT, une seule est une caractéristique du tissu cardiaque d'un adulte. Ceci est détecté avec des anticorps spécifiques conçus contre l'extrémité N-terminale de sa séquence aminooacidale.
Les tests de «nouvelle génération» pour la sous-université t de l'isoforme cardiaque accordent beaucoup d'attention au fait que certains tissus squelettiques blessés peuvent réexparer cette isoforme, de sorte que des réactions croisées peuvent être obtenues avec les anticorps.
Les références
- Babuin, l., & Jaffe, un. S. (2005). Troponine: le biomarqueur de choix pour la détection des lésions cardiaques. CMAJ, 173(10), 1191-1202.
- Collinson, P., Stubbs, P., & Kessler, un.-C. (2003). Évaluation multiderne. Cœur, 89, 280-286.
- Farah, C., & Reinach, f. (Année mille neuf cents quatre-vingts-quinze). Le complexe de troponine et la régulation de la contraction musculaire. Faseb, 9, 755-767.
- Keller, T., Peetz, D., Tzikas, s., Roth, un., Czyz, E., Bickel, c.,... Blankenberg, S. (2009). Troponine I sensible au test dans un diagnostic précoce de l'infarcation myocardique aiguë. The New England Journal of Medicine, 361(9), 868-877.
- Ross, M., & Pawlina, W. (2006). Histologie. Un texte et un atlas avec une biologie cellulaire et moléculaire corrélée (5e Ed.). Lippinott Williams et Wilkins.
- Wakabayashi, t. (2015). Mécanisme de la régulation du calcium de la contraction musculaire. Dans la poursuite de sa base structurelle. Procure. JPN. Acade. Être. B, 91, 321-350.
- « Caractéristiques, structures et fonctions de la tropomiosine
- Concept de chaleur sensible, formules et exercices résolus »

