Structure de triéthilamine, propriétés, utilisations et risques

- 3835
- 581
- Eva Henry
La triéthilamine C'est un composé organique, plus précisément une amine aliphatique, dont la formule chimique est n (ch2Ch3)3 ou net3. Comme les autres amines liquides, il présente une odeur similaire à celle de l'ammoniac mélangé à du poisson; Ses vapeurs rendent fastidieux et dangereux manipuler cette substance sans extracteur ou vêtements appropriés.
En plus de ses formules respectives, elle est généralement abrégée à ce composé en TSA; Cependant, cela peut provoquer une confusion avec d'autres amines, comme la trietanolamine, n (Ethoh)3, ou le tétraetilamonium, un amina quaternaire, filet4+.
 Squelette de triéthylamine. Source: mélanges [CC BY-SA 3.0 (http: // CreativeCommons.Org / licences / by-sa / 3.0 /]]
Squelette de triéthylamine. Source: mélanges [CC BY-SA 3.0 (http: // CreativeCommons.Org / licences / by-sa / 3.0 /]] De son squelette (image supérieure), on peut dire que la triéthylamine est assez similaire à l'ammoniac; Tandis que le second a trois hydrogènes, NH3, Le premier a trois groupes éthyliques, n (ch2Ch3)3. Sa synthèse commence à partir du traitement de l'ammoniac liquide avec de l'éthanol, se produisant une alkylation.
Le net3 Vous pouvez former un sel hygroscopique avec du HCl: chlorhydrate de triéthilamine, filet3· HCL. En plus de cela, il participe en tant que catalyseur homogène dans la synthèse des esters et des amidas, c'est donc un solvant nécessaire dans les laboratoires organiques.
De plus, avec d'autres réactifs, il permet l'oxydation des alcools primaires et secondaires aux aldéhydes et cétones, respectivement. Comme l'ammoniac est une base, et par conséquent, il peut former des sels organiques par des réactions de neutralisation.
[TOC]
Structure de la triéthylamine
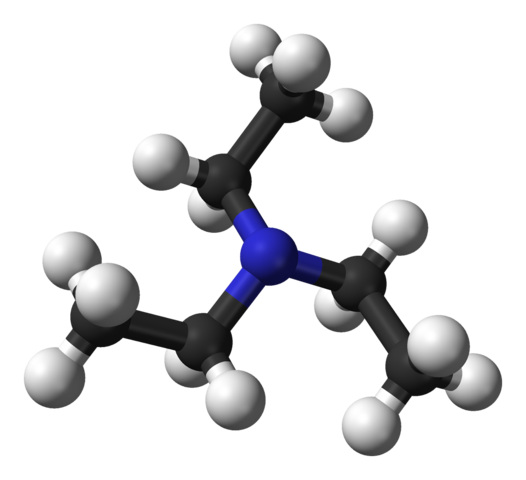 Structure de la triéthylamine. Source: Benjah-Bmm27 [domaine public].
Structure de la triéthylamine. Source: Benjah-Bmm27 [domaine public]. L'image supérieure montre la structure de la triéthylamine avec un modèle de sphères et de barres. Au centre de la molécule, l'atome d'azote est situé, représenté par une sphère bleuâtre; Et liés à lui, les trois groupes éthyliques, comme les petites branches de sphères noires et noires.
Bien qu'ils ne soient pas à l'œil nu, sur l'atome d'azote, il y a quelques électrons non partagés. Ces deux électrons et les trois groupes -ch2Ch3 Ils connaissent des répulsions électroniques; Mais d'un autre côté, ils contribuent à définir le moment dipolaire de la molécule.
Peut vous servir: cycloalcanos: propriétés, réactions, utilisations, exemplesCependant, un tel moment dipolaire est inférieur à celui, par exemple, de la diéthylamine, NHET2; Et aussi, il manque de possibilité de former des ponts d'hydrogène.
En effet, dans la triéthylamine, il n'y a pas de liaison N-H, et par conséquent, des points de fusion et d'ébullition mineurs sont observés par rapport à d'autres amines qui interagissent de cette manière.
Bien qu'il y ait un léger moment dipolaire, les forces de dispersion entre les groupes éthyliques de molécules nettes ne peuvent pas être exclues3 voisins. Ajoutant cet effet, il est justifié de savoir pourquoi, bien que la triéthylamine soit volatile, elle bouillonne autour de 89 ° C, grâce à sa masse moléculaire relativement grande.
Propriétés
Apparence physique
Liquide incolore avec une odeur désagréable d'ammoniac et de poisson.
Masse molaire
101,193 g / mol.
Point d'ébullition
89 ° C.
Point de fusion
-115 ° C. Notez à quel point les forces intermoléculaires sont faibles qui unissent les molécules de triéthylamine dans leur solide.
Densité
0,7255 g / ml.
Solubilité
Il est relativement soluble dans l'eau, 5,5 g / 100 g à 20 ° C. En dessous de 18,7 ºC, selon PubChem, il est même miscible avec cela.
En plus de "s'entendre" avec l'eau, il est également soluble dans l'acétone, le benzène, l'éthanol, l'éther et la paraffine.
Densité de vapeur
3.49 par rapport à l'air.
La pression de vapeur
57,07 mmHg à 25 ° C.
Henry Constant
66 μmol / pa · kg.
point d'allumage
-15 ° C.
Température d'auto-direction
312ºC.
Capacité thermique
216,43 kJ / mol.
Chaleur de combustion
dix.248 chaux / g.
Chaleur de vaporisation
34,84 kJ / mol.
Tension superficielle
20,22 N / m A 25ºC.
Indice de réfraction
1 400 à 20 ° C.
Gelée
0,347 MPa · s à 25ºC.
Constante de basicité
La trieLamine a un PKB égal à 3,25.
Basicité
La basicité de cette amine peut être exprimée par l'équation chimique suivante:
Peut vous servir: polymères synthétiquesFilet3 + Ha nhet3+ + POUR-
Où est-ce une espèce acide faible. La paire NHET3+POUR- Il forme ce qui devient un sel d'ammonium tertiaire.
Acide conjugué NHET3+ Il est plus stable que l'ammonium, NH4+, Parce que les trois groupes éthyliques donnent une partie de leur densité électronique pour réduire la charge positive sur l'atome d'azote; Par conséquent, la triéthylamine est plus basique que l'ammoniac (mais moins basique que OH-).
Applications
 Réactions catalysées par la triéthylamine. Source: Tachymètre [domaine public].
Réactions catalysées par la triéthylamine. Source: Tachymètre [domaine public]. La basicité, dans ce cas, la nucléophilicité de la triéthylamine est utilisée pour catalyser la synthèse de l'ester et des amides d'un substrat commun: un chlorure d'acyle, RCOCL (image supérieure).
Ici, la paire libre d'électrons azotés attaque le groupe carbonyle, formant un intermédiaire; qui, consécutivement, est attaqué par un alcool ou une amine pour former un ester ou un amida, respectivement.
Dans la première rangée de l'image, le mécanisme qui suit la réaction pour produire l'ester est visualisé, tandis que la deuxième ligne correspond à l'amida. Notez que dans les deux réactions, le chlorhydrate de triéthylamine se produit, net3· HCl, à partir duquel le catalyseur est récupéré pour démarrer un autre cycle.
Polymères
La nucléophilicité de la triéthylamine est également utilisée pour ajouter certains polymères, les guérir et leur donner des masses plus grandes. Par exemple, il fait partie de la synthèse des résines polycarbonatées, des mousses en polyuréthane et des résines époxy.
Chromatographie
Son amphifilicité et sa volatilité éloignées permet à ses sels dérivés d'être utilisés comme réactifs dans la chromatographie d'échange d'ions. Une autre utilisation implicite de la triéthylémine est que plusieurs sels d'amines tertiaires peuvent en être obtenus, comme le bicarbonate de triéthylamine, NHET3HCO3 (ou Teab).
Peut vous servir: calorimétrie: quelles études et applicationsProduits commerciaux
Il a été utilisé comme additif dans la formulation de cigarettes et de tabac, de conservateurs alimentaires, de planchers, d'arôme, de pesticides, de colorants, etc.
Des risques
Les vapeurs de la triéthylamine sont non seulement désagréables mais dangereuses, car ils peuvent irriter le nez, la gorge et les poumons pour provoquer un œdème pulmonaire ou une bronchite. De même, étant denses et lourdes que l'air, ils restent au niveau du sol, se déplaçant vers d'éventuelles sources de chaleur pour exploser par la suite.
Les conteneurs de ce liquide doivent être aussi loin du feu car ils représentent un danger imminent d'explosion.
De plus, un contact avec des espèces ou des réactifs tels que: les métaux alcalins, l'acide tricloroacétique, les nitrates, l'acide nitrique (comme il formerait des nitrosoamines, des composés cancérigènes), des acides puissants, des peroxydes et des permanguates.
Vous ne devez pas toucher l'aluminium, le cuivre, le zinc ou ses alliages, car il a la capacité de les corroder.
En ce qui concerne le contact physique, il peut provoquer des allergies et des éruptions cutanées si l'exposition est aiguë. En plus des poumons, il peut affecter le foie et les reins. Et en ce qui concerne le contact oculaire, il provoque une irritation, ce qui pourrait même endommager les yeux s'ils ne sont pas traités ou nettoyés dans le temps.
Les références
- Morrison, R. T. Et Boyd, R, n. (1987). Chimie organique. 5e édition. Éditorial Addison-Wesley Inter-American.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (10e édition.). Wiley Plus.
- Wikipédia. (2019). Triéthylamine. Récupéré de: dans.Wikipédia.org
- Miserrer. (2019). Triéthylamine. Récupéré de: Sigmaaldrich.com
- Centre national d'information sur la biotechnologie. (2019). Triéthylamine. Base de données PubChem. CID = 8471. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Réseau de données toxicologie. (s.F.). Triéthylamine. Récupéré de: toxnet.NLM.NIH.Gouvernement
- Département de la santé du New Jersey. (2010). Triéthylamine. Récupéré de: NJ.Gouvernement
- « 10 curiosités sur le Moyen Âge qui vous surprendront
- Structure alcoolique isoamilico, propriétés, utilisations et risques »

