Structure alcoolique isoamilico, propriétés, utilisations et risques
- 1900
- 336
- Prof Ines Gaillard
Il Alcool isoamylique C'est un composé organique dont la formule est (ch3)2Chch2Ch2Oh. Chimiquement parlant est un alcool primaire ramifié et constitue l'un des isomères de pentanol, appelés alcools amyl (c5H12SOIT).
Comme de nombreux alcools de faible poids moléculaire, c'est un liquide incolore à température ambiante. Cela permet et facilite qu'il soit utilisé comme solvant pour différentes applications; De plus, lorsqu'il n'exerce pas trop d'effets négatifs sur l'écosystème après avoir jeté.
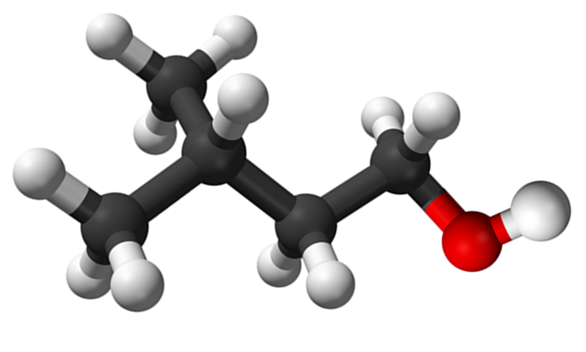
 Molécule d'alcool isoamilique. Source: Claudio Pistilli de Wikipedia.
Molécule d'alcool isoamilique. Source: Claudio Pistilli de Wikipedia. Bien qu'il s'agisse d'un matériau intermédiaire dans la synthèse de l'acétate d'amilo pour l'élaboration des parfums de bananes, sa propre odeur est désagréable et similaire à celle des poires.
En plus de servir de solvant de substances biologiques multiples et d'intermédiaire dans la synthèse d'autres acétats, il réduit la tension de surface de certaines formulations industrielles, empêchant les mousses de se former. Par conséquent, il est utilisé dans les systèmes micro-émulsifiés.
En ce qui concerne son origine naturelle, l'alcool isoamilique a été trouvé dans les Horomonas des Hornets et dans les truffes noires, un type de champignons situés dans le sud-est européen.
[TOC]
Structure isoamilico
Dans l'image supérieure, la molécule d'alcool isoamylique représentée avec un modèle de sphères et de barres a été montrée. À droite de la même chose, la sphère rougeâtre correspond à l'atome d'oxygène du groupe OH, caractéristique pour tous les alcools; Pendant la gauche, il y a le squelette gazéidé avec un groupe méthyle, CHO3, Brancer la structure.
D'un point de vue moléculaire, ce composé est dynamique pour avoir des atomes avec des hybrides SP3, faciliter la rotation de leurs liens; Tant que cela ne fait pas éclipser l'OH et le CHO3.
Il convient également de mentionner sa caractéristique amphiphile: il a une extrémité apolaire ou hydrophobe, constituée par la chaîne (ch3)2Chch2Ch2-, et une tête polaire ou hydrophile, le groupe OH. Cette définition de deux zones spécifiques de polarités différentes fait de cet alcool une tensiabilité; Et à partir de là, il est dû à sa demande de microémulsions.
Peut vous servir: règle de levierInteractions intermoléculaires
Étant donné la présence du groupe OH, la molécule d'alcool isoamilique présente un moment dipolaire permanent. Par conséquent, le dipol-dipol.
Alors que la branche des chaînes principales diminue les interactions efficaces entre les molécules, les ponts d'hydrogène dans cet alcool compensent cette descente, faisant bouillir le liquide à 131 ° C, température supérieure au point d'ébullition de l'eau.
Il ne se produit pas avec son solide ou «glace», qui fond à -117 ° C, indiquant que ses interactions intermoléculaires ne sont pas assez fortes pour garder leurs molécules de manière ordonnée; Surtout si le groupe CHO3 qui branche la chaîne principale empêche un meilleur contact entre les molécules.
Propriétés
Apparence physique
Liquide incolore.
Odeur et goût
Rejette une odeur désagréable similaire à celle de la poire et a une saveur vive.
Masse molaire
88 148 g / mol.
Densité
0,8104 g / ml à 20 ° C. Il est donc moins dense que l'eau.
Densité de vapeur
C'est 3,04 fois plus dense que l'air.
La pression de vapeur
2,37 mmHg à 25 ° C.
Point d'ébullition
131,1 ° C.
Point de fusion
-117,2 ° C.
point d'allumage
43 ° C (tasse fermée).
Température d'auto-direction
340 ° C.
Solubilité
Il est relativement soluble dans l'eau: 28 g / L. En effet. En cas de mélange, deux phases seraient observées: une plus faible, correspondant à l'eau, et un supérieur, celle de l'alcool isoamylique.
En revanche, il est beaucoup plus soluble dans les solvants moins polaires tels que: l'acétone, l'éther, le chloroforme, l'éthanol ou l'acide acétique glaciaire; Et même dans l'éther d'huile.
Il peut vous servir: Thermomètre de laboratoire: caractéristiques, à quoi sert-il, utilisation, exemplesGelée
3 738 cp à 25 ° C.
Tension superficielle
24,77 Dins / cm A 15 ° C.
Indice de réfraction
1 4075 à 20 ° C.
Capacité thermique
2 382 kJ / g · k.
Applications
Matière première
De l'alcool isoamilique d'autres esters, le thiophène et les drogues telles que le nitrite amilo, le validol (mental isavalerate), la brommisoval (bromobalerilurea), le corvalol (un tranquanar callerian) et le barbare (amobarbital) (amobarbital) et l'appel) et Barbamil (amobarbital) (amobarbital).
Parfums
En plus d'être utilisé pour la synthèse de l'acétate d'amilo, qui a un arôme de banane, d'autres parfums de fruits tels que l'abricot, les oranges, la prune, la cerise et le malt sont également obtenus. Par conséquent, c'est un alcool nécessaire dans l'élaboration de nombreux produits comestibles ou cosmétiques.
Antispumant
En réduisant la tension de surface, il favorise son utilisation dans les systèmes micro-émulsifiés. Pratiquement, évitez la formation de bulles accélérées, les réduisant en taille pour les casser.
Il aide également à mieux définir l'interface entre les phases aqueuses et organiques pendant les extractions; Par exemple, il est ajouté au mélange d'extracteur Fenol-chloroforme dans une proportion de 25: 1. Cette technique est destinée à l'extraction d'ADN.
Extractions
L'alcool isoamylique vous permet également d'extraire des graisses ou des huiles de différents échantillons, par exemple le lait. Dissolvez également de la cire de paraffine, des encres, du caoutchouc, des laques et des esters de cellulose.
Poursuivant avec des extractions, vous pouvez obtenir de l'acide phosphorique à partir de solutions minérales phosphatoires fer.
Des risques
Stockage et réactivité
Comme tout liquide qui dégage des odeurs, il peut représenter un risque imminent de feu si l'endroit où sa température est trop stockée, il y a encore plus s'il y a déjà une source de chaleur.
Dans ces conditions, il agit simplement comme un carburant, alimentant les flammes et même exploitant son conteneur. Lors de la brûlure, libérez des vapeurs qui peuvent affecter la santé et provoquer la suffocation.
Peut vous servir: analyse quantitative en chimie: mesures, préparationAutres causes que l'alcool isoamilique est mis en feu est de le mélanger ou de le réagir avec des substances telles que: peroxydes, broma.
Santé
En contact avec la peau, vous pouvez l'irriter et le sécher. Les symptômes, cependant, sont plus graves s'ils sont inhalés trop longtemps (toux, brûlures de nez, gorge et poumons), ou si elles sont ingérées (maux de tête, nausées, diarrhée, vomissements, étourdissements et perte de connaissances).
Et enfin, quand il se déverse dans les yeux les irrite et peut même leur faire du mal de manière irréversible. Heureusement, son odeur de «poires alcooliques» vous permet de la détecter en cas d'évasion ou de déversement; En plus de cela, c'est un composé qui doit être manipulé avec respect.
Les références
- Morrison, R. T. Et Boyd, R, n. (1987). Chimie organique. 5e édition. Éditorial Addison-Wesley Inter-American.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (10e édition.). Wiley Plus.
- Wikipédia. (2019). Alcool isoamylique. Récupéré de: dans.Wikipédia.org
- Centre national d'information sur la biotechnologie. (2019). Alcool isoamylique. Base de données PubChem. CID = 31260. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Zhang Yu et Muhammed Mamoun. (17 septembre 2008). Extraction de l'acide phosphorique à partir de solutions de nitrate avec de l'alcool isoamylique. Extraction des solvants et échange d'ions Volume 6, 1988 - numéro 6. est ce que je.org / 10.1080/07366298808917973
- Département de la santé du New Jersey. (2008). Alcool isoamylique. [PDF]. Récupéré de: NJ.Gouvernement
- Kat Chem. (2019). Alcool isoamylique. Récupéré de: Kat-Chem.Hu
- Chemoxy International Ltd. (s.F.). Alcool isoamylique. Récupéré de: Chemoxy.com
- « Structure de triéthilamine, propriétés, utilisations et risques
- Histoire et signification du drapeau du Liechtenstein »

