Topoisomérase ce que sont, les caractéristiques, les fonctions, les types
- 4213
- 61
- Raphaël Charles
Le Topoisomérase Ce sont un type d'enzymes d'isoméraft qui modifient la topologie de l'acide désoxyribonucléique (ADN), générant à la fois leur déroulement et son curling et leur chevauchement.
Ces enzymes ont un rôle spécifique dans le soulagement de la tension de torsion dans l'ADN afin que de tels processus importants puissent se produire, la transcription de l'ADN dans l'acide ribonucléique messager (RNAM) et la recombinaison de l'ADN.
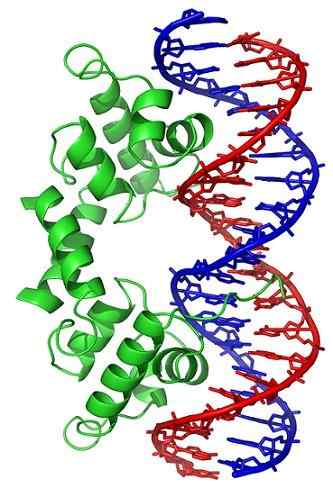
 Topoisomerase II, Wikimedia Commons
Topoisomerase II, Wikimedia Commons Des enzymes de topoisomérase sont présentes dans les cellules eucaryotes et les cellules procaryotes. Son existence a été prédite par les scientifiques Watson et Crick, lors de l'évaluation des limites que la structure d'ADN a présentée pour permettre l'accès à leurs informations (stockées dans sa séquence nucléotidique).
Pour comprendre les fonctions de la topoisomérase, il convient de considérer que l'ADN a une structure à double hélice stable, avec ses chaînes enroulées l'une sur l'autre.
Ces chaînes linéaires sont constituées par des 2-dechexiribosas liés par un phosphodi-foser 5'-3 '.
L'étude topologique des molécules d'ADN a montré que celles-ci peuvent supposer plusieurs conformations dépendant de leur tension de torsion: d'un état détendu à différents états d'inscription qui permettent leur compactage.
Les molécules d'ADN avec différentes conformations sont appelées topoisomères. Ainsi, nous pouvons conclure que les topoisomérases I et II peuvent augmenter ou diminuer la tension de la torsion des molécules d'ADN, formant leurs différentes topoisomères.
Parmi les topoisomères ADN possibles, la conformation la plus courante est celle de Superstrane, qui est très compacte. Cependant, la double hélice ADN doit également être non contraire aux topoisomérases pendant plusieurs processus moléculaires.
Caractéristiques
Mécanisme d'action générale
Certaines topoisomérases ne peuvent détendre que l'écrasement négatif de l'ADN, ou les deux superstrans d'ADN: positif et négatif.
Si l'ADN dynamique circulaire se déroule sur son axe longitudinal et un revogira retourne (en direction des aiguilles d'horloge), il est dit qu'il se chevauche négativement. Si le retour est dextrogyral (contrairement aux aiguilles d'horloge), il est positivement dépassé.
 Président circulaire circulaire d'ADN négativement, détendu et dépassé positivement. Source: fdardel [cc by-sa 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)], de Wikimedia Commons
Président circulaire circulaire d'ADN négativement, détendu et dépassé positivement. Source: fdardel [cc by-sa 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)], de Wikimedia Commons Fondamentalement, les topoisomérases peuvent:
-Faciliter le passage d'un brin d'ADN à travers une coupe dans le brin opposé (Topoisomerase Type I).
-Faciliter le passage d'une double hélice complète à travers une scission en soi, ou à travers une scission dans une double hélice différente (Topoisomerase Type II).
En résumé, la topoisomérase agit à travers le fractionnement des liens de phosphodiéster, dans un ou les deux brins qui composent l'ADN. Ensuite, ils modifient l'état de roulement des brins d'une double hélice (momémomérase topoisomérase) ou deux propulseurs doubles (momémomérase II), pour enfin lier à nouveau ou lier les extrémités fendues.
Topoisomérase et cycle cellulaire
Bien que la topoisomérase I soit une enzyme qui a la plus grande activité pendant la phase S (synthèse d'ADN), elle n'est pas considérée comme dépendante d'une phase de cycle cellulaire.
Peut vous servir: Lipides saponifiables: caractéristiques, structure, fonctions, exemplesTandis que l'activité topoisomérase II est plus active pendant la phase logarithmique de la croissance cellulaire et des cellules de croissance rapide.
Les fonctions
L'altération des gènes qui codent. Parmi les processus dans lesquels participent la topoisomérase, figurent:
Stockage compact de matériaux génétiques
Les topoisomérases facilitent le stockage d'informations génétiques compactes, car elles génèrent le roulement et le chevauchement de l'ADN, permettant à une grande quantité d'informations d'être dans un volume relativement petit.
Accès aux informations génétiques
S'il n'y a pas de topoisomérase et de leurs caractéristiques uniques, l'accès aux informations stockées dans l'ADN serait impossible. Cela est dû au fait que la topoisomérase libère périodiquement la tension due à la torsion générée dans l'hélice à double ADN, pendant leur déroulement, dans les processus de réplication, de transcription et de recombinaison.
Si la tension due à la torsion générée au cours de ces processus n'est pas libérée, une expression de gène défectueuse pourrait se produire, l'interruption de l'ADN circulaire ou du chromosome, produisant même la mort cellulaire.
Régulation de l'expression des gènes
Les changements conformationnels (dans la structure à trois dimensions) de la molécule d'ADN, exposent des régions spécifiques, qui peuvent interagir avec les protéines d'ADN. Ces protéines ont une fonction régulatrice de l'expression génétique (positive ou négative).
 Expression génétique Protéine régulatrice. Wikimedia Commons
Expression génétique Protéine régulatrice. Wikimedia Commons Ainsi, l'état de roulement de l'ADN, généré par l'action des topoisomérases, affecte la régulation de l'expression génétique.
Les particularités de la topoisomérase II
La topoisomérase II est nécessaire pour l'assemblage des chromatides, la condensation et les chromosomes et la ségrégation des filles d'ADN pendant la myitose pendant la myitose.
Cette enzyme est également une protéine structurelle et l'un des principaux constituants de la matrice de noyau cellulaire pendant l'interface.
Types de topoisomérase
Il existe deux principaux types de topoisomérases selon qu'elles sont capables de diviser une ou deux chaînes d'ADN.
-Topoisomerase Type I
Monomère
La topoisomérase de type I est des monomères qui soulagent l'écrasement négatif et positif, qui sont produits par le mouvement de la fourche pendant la transcription et pendant les processus de réplication et de recombinaison des gènes.
Les topoisomérases de type I peuvent être subdivisées en type 1A et type 1B. Ces derniers sont ceux trouvés chez l'homme et sont responsables de la relaxation de l'ADN de l'aperçu.
Tyrosine dans sa place active
La topoisomérase 1B (TOP1B) est composée de 765 acides aminés divisés en 4 domaines spécifiques. L'un de ces domaines a une zone très conservée qui contient le site actif avec la tyrosine (Tyr7233). Toute la topoisomérase présente dans leur site actif une tyrosine avec un rôle fondamental dans tout le processus catalytique.
Mécanisme d'action
La tyrosine du site actif forme une liaison covalente avec l'extrémité 3'-phosphate de la chaîne d'ADN, la coupant et la gardant avec l'enzyme, tandis qu'un autre brin d'ADN passe par la scission.
Il peut vous servir: flore et faune de la Sierra équatorienne: espèces représentativesLe passage de l'autre brin d'ADN à travers le brin fendu, est réalisé grâce à une transformation conformationnelle de l'enzyme, qui produit l'ouverture de la double hélice de l'ADN.
Ensuite, la topoisomérase I revient à sa conformation initiale et ligate à nouveau les extrémités divisées. Cela se produit en raison d'un processus inverse à la rupture de la chaîne d'ADN, dans le site catalytique de l'enzyme. Enfin, la topoisomérase libère le brin d'ADN.
Le taux de ligature de l'ADN est supérieur au taux de division, ce qui garantit la stabilité de la molécule et l'intégrité du génome.
En résumé, la topoisomérase de type I:
- La scission d'un brin.
- Le passage de l'autre brin à travers la scission.
- La ligature des extrémités se sépare.
-Topoisomérase de type II
Variateur
Les topoisomérases de type II sont des enzymes de dimérica, qui sont divisées.
Mg dépendant++ et ATP
Ces enzymes ont besoin de magnésium (mg++) Et ils ont également besoin de l'énergie qui vient de la rupture du lien ATP Triffosphate, qui profite d'un merci à une ATPase.
Deux sites actifs avec la tyrosine
Les topoisomérases humaines sont très similaires à celles de la levure (Saccharomyces cerevisiae), qui est composé de deux monomères (sous-fragments a et b). Chaque monomère présente un domaine ATPASA, et dans un sous-fragment le site actif Tyrosine 782, auquel l'ADN peut être rejoint. Par conséquent, deux brins d'ADN peuvent être joints à la topoisomérase II.
Mécanisme d'action
Le mécanisme d'action de la topoisomérase II est égal à celui décrit pour Topoisomease I, étant donné que deux chaînes d'ADN sont divisées et pas seulement une.
Dans le site actif de la topoisomérase II, il est stabilisé (par une union covalente avec la tyrosine) un fragment de hélice double de l'ADN, appelé "fragment G". Ce fragment est divisé et maintenu ensemble sur le site actif par des liaisons covalentes.
Ensuite, l'enzyme permet à un autre fragment d'ADN, appelé "fragment t", de passer par le fragment divisé "G", grâce à un changement conformationnel de l'enzyme, qui dépend de l'hydrolyse ATP.
La topoisomérase II Liga les deux extrémités du "fragment G" et finalement récupérer son état initial, libérant le fragment "G". Ensuite, l'ADN détend la tension de torsion, permettant aux processus de réplication et de transcription se produisent.
-Topoisomérase humaine
Le génome humain a cinq topoisomérase: top1, top3α, top3β (de type I); et top2α, top2β (type II). Les topoisomérases humaines les plus pertinentes sont TOP1 (Topoisomerase Type IB) et 2α (Topoisomerase Type II).
Inhibiteurs de la topoisomérase
-Topoisomérase comme objectif d'attaque chimique
Parce que les processus catalysés par les topoisomérases sont nécessaires pour la survie des cellules, ces enzymes sont une bonne attaque blanche pour affecter les cellules malignes. Par conséquent, la topoisomérase est considérée comme importante dans le traitement de nombreuses maladies humaines.
Les médicaments qui interagissent avec la topoisomérase sont actuellement très étudiés comme substances chimiothérapeutiques contre les cellules cancéreuses (dans différents organes du corps) et les micro-organismes pathogènes.
Peut vous servir: glycogène: structure, synthèse, dégradation, fonctions-Types d'inhibition
Les médicaments inhibiteurs de l'activité de la topoisomérase peuvent:
- Intercalate d'ADN.
- Affecter l'enzyme de topoisomérase.
- Intercller dans une molécule près du site actif de l'enzyme tandis que le complexe ADN-topoisomérase est stabilisé.
La stabilisation du complexe transitoire formé par l'union de l'ADN à la tyrosine du site catalytique de l'enzyme, empêche l'union des fragments divisés, ce qui peut entraîner la mort cellulaire.
-Médicaments inhibiteurs de la topoisomérase
Parmi les composés qui inhibent la topoisomérase, sont les suivants.
Antibiotiques antitumoraux
Les antibiotiques sont utilisés contre le cancer, car ils empêchent la croissance des cellules tumorales, interférant généralement avec leur ADN. Ils sont généralement appelés antibiotiques antinéoplasiques (contre le cancer). L'actinomycine d, par exemple, affecte la topoisomérase II et est utilisée dans les tumeurs de Wilms chez les enfants et dans les rabomiosarcomes.
Anthracyclines
Les anthracyclines sont, parmi les antibiotiques, des médicaments anti-cancer les plus efficaces et un spectre plus large. Ils sont utilisés dans le traitement du cancer du poumon, des ovaires, de l'utérus, de l'estomac, de la vessie, du sein, de la leucémie et des lymphomes. Il est connu qu'il affecte la topoisomérase II par intercalation dans l'ADN.
La première anthracycline isolée d'une actinobactérie (Streptomyces peucetius) C'était la daunorubicine. Par la suite, la doxorubicine a été synthétisée en laboratoire, et l'épirubicine est également utilisée et idarubicine.
Antraquinones
Les antraquinones ou les antracènes sont des composés dérivés de l'anthracène, similaires aux anthracyclines, qui affectent l'activité de la topoisomérase II par intercalation dans l'ADN. Ils sont utilisés pour le cancer du sein métastatique, le lymphome non hodgkinien (LNH) et la leucémie.
Ces médicaments ont été trouvés dans les pigments de certains insectes, plantes (Frogula, Sen, Rhibarb), lichens et champignons; ainsi qu'à La Hoelita, qui est un minéral naturel. Selon votre dose, ils peuvent être cancérigènes.
Parmi ces composés, nous avons le mythoxantrona et son analogue le losxantrona. Ceux-ci empêchent la prolifération des cellules tumorales malignes, en joignant de l'ADN de manière irréversible.
Épidophilotoxines
Les podofilotoxines, telles que les épidophilotoxines (VP-16) et le teniposide (VM-26), forment un complexe avec la topoisomérase II. Ils sont utilisés contre le poumon, le cancer des testicules, la leucémie, les lymphomes, le cancer de l'ovaire, le carcinome du sein et les tumeurs intracrâniennes malignes, entre autres. Sont isolés des plantes Podophyllum notatum et P. Peltatum.
Analogues camptotecines
Les campotecines sont des composés qui inhibent la topoisomérase I, et parmi eux sont l'irinotécan, le topote.
Ces composés ont été utilisés contre le cancer du côlon, du poumon et du sein, et sont naturellement obtenus à partir de la croûte et des feuilles des espèces d'arbres Camptotheca accuminata du chinois et du Tibet Cornace.
Inhibition naturelle
Des altérations structurelles des topoisomérases I et II peuvent également se produire de manière complètement naturelle. Cela peut se produire lors de certains événements qui affectent votre processus catalytique.
Parmi ces modifications, la formation de diamètres de pyrimidine, la décalage des bases d'azote et d'autres événements causés par le stress oxydatif peuvent être cités.
Les références
- Liu, L. F. (1994). ADN topoisomérase: médicaments ciblant la topoisomérase. Presse universitaire. pp 307
- Osheroff, n. et bjorsti, m. (2001). ADN topoisomérase. Enzymologie et médicaments. Vol. Ii. Presse humaine. Pp 329.
- « Caractéristiques des macrophytes, habitat, classification et importance
- 20 inventions de la Renaissance qui ont changé le monde »

