Atome neutre
- 3342
- 176
- Raphaël Meyer
Qu'est-ce qu'un atome neutre?
UN atome neutre C'est celui qui manque de charge électrique en raison de la compensation entre le nombre de ses protons et électrons. Les deux sont des particules subatomiques chargées électriquement.
Les protons sont agglomérés à côté des neutrons et composent le noyau; tandis que les électrons sont flous en définissant un nuage électronique. Lorsque le nombre de protons dans un atome, égal à son nombre atomique (z), est égal au nombre d'électrons, il est dit qu'il existe une compensation entre les charges électriques dans l'atome.
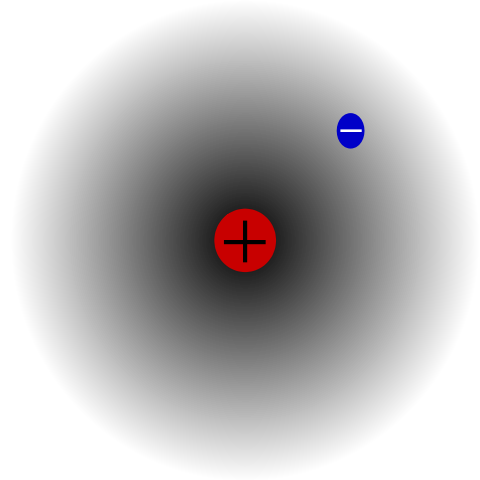
 Atome d'hydrogène. Source: METS501 via Wikipedia.
Atome d'hydrogène. Source: METS501 via Wikipedia. Il y a par exemple un atome d'hydrogène (image supérieure), qui a un proton et un électron. Le proton est positionné au centre de l'atome comme son noyau, tandis que l'électron orbite l'espace environnant, laissant des régions de densité moins électronique lorsqu'elle s'éloigne du noyau.
Il s'agit d'un atome neutre car il est vrai que z est égal au nombre d'électrons (1p = 1e). Si l'atome de H perdait ce proton unique, le rayon atomique était haussé des épaules et prévaudrait la charge du proton, devenant le cation h+ (Hydron). Si, d'un autre côté, il gagnait un électron, il y aurait deux électrons et deviendrait anion h-- (Hydrure).
Atome neutre vs ion
Pour l'exemple de l'atome neutre de H, il a été constaté qu'il est accompli que le nombre de protons équivaut au nombre d'électrons (1p = 1e); situation qui ne se produit pas avec les ions dérivés de La perte ou le gain d'un électron.
Les ions sont formés par un changement dans le nombre d'électrons, soit parce que l'atome gagne (-) ou les perdre (+).
Peut vous servir: phase disperséeDans l'atome de cation h+ Le Valencia du proton solitaire prédomine face à l'absence totale d'un électron (1p> 0e). Cela est vrai pour tous les autres atomes plus lourds (np> ne) du tableau périodique.
Bien que la présence d'un fardeau positif puisse sembler insignifiante, elle modifie en diagonale les caractéristiques de l'élément en question.
D'un autre côté, dans l'atome anion- La charge négative des deux électrons prédomine devant le seul proton du noyau (1p<2e). Igualmente, los demás aniones de mayor masa tienen un exceso de electrones en comparación al número de protones (np
Na vs na+
Un exemple mieux connu est celui du sodium métallique. Son atome neutre, Na, avec z = 11, a 11 protons; Par conséquent, il doit y avoir 11 électrons pour compenser les charges positives (11p = 11e).
Le sodium pour être un élément métallique hautement électropositif, perd très facilement ses électrons; Dans ce cas, il ne perd qu'un seul, celui de sa couche de valence (11p> 10e). Ainsi, le na cation est formé+, qui interagit électrostatiquement avec un anion; Comme le chlorure, CL-, Dans le sel de chlorure de sel, NaCl.
Le sodium métallique est toxique et corrosif, tandis que son cation est même présent à l'intérieur des cellules. Cela montre comment les propriétés d'un élément peuvent varier considérablement lorsqu'elle gagne ou perd des électrons.
D'un autre côté, le nion na- (Soduro, hypothétiquement) n'existe pas; Et pour pouvoir se former, ce serait extrêmement réactif, car il va à l'encontre de la nature chimique du sodium pour gagner des électrons. Puis un- Il aurait 12 électrons, surmontant la charge positive de son noyau (11p<12e).
Peut vous servir: oxygène moléculaire: structure, propriétés, utilisationsMolécules neutres
Les atomes sont liés de manière covalente pour donner naissance à des molécules, ce que le composé peut également être appelé. Dans une molécule, il ne peut y avoir d'ions isolés; Au lieu de cela, il y a des atomes avec des charges formelles positives ou négatives. Ces atomes chargés affectent la charge nette de la molécule, la transformant en un ion polymymique.
Pour qu'une molécule soit neutre, la somme des charges formelles de ses atomes doit être égale à zéro; Ou, plus simplement, tous ses atomes sont neutres. Si les atomes qui composent une molécule sont neutres, ce sera également.
Par exemple, vous avez la molécule d'eau, H2SOIT. Ses deux atomes H sont neutres, tout comme l'atome d'oxygène. Ils ne peuvent pas être représentés de la même manière que sur l'image de l'atome d'hydrogène; Puisque, bien que le noyau ne change pas, le nuage électronique.
L'hydronio ion, h3SOIT+, D'un autre côté, il a un atome d'oxygène avec une charge partielle positive. Cela signifie que dans cette ion polyiatomique, il perd un électron et, par conséquent, son nombre de protons est supérieur à celui de ses électrons.
Exemples d'atomes neutres
Oxygène
L'atome d'oxygène neutre a 8 protons et 8 électrons. Lorsqu'il gagne deux électrons, forme ce que l'on appelle l'oxyde anion, ou2-. Dans ce document, les charges négatives prédominent, ayant un excès de deux électrons (8p<10e).
Les atomes d'oxygène neutre ont une forte tendance à réagir et à se joindre à elles-mêmes pour se former ou2. C'est pour cette raison qu'il n'y a pas d'atomes ou de "lâche" à votre sort et sans réagir avec rien. Toutes les réactions connues pour ce gaz sont attribuées à l'oxygène moléculaire, ou2.
Il peut vous servir: métaux alcalinotherresCuivre
Le cuivre a 29 protons et 29 électrons (en plus des neutrons). Contrairement à l'oxygène, leurs atomes neutres peuvent être trouvés dans la nature en raison de leur liaison métallique et de leur stabilité relative.
Comme le sodium, il a tendance à perdre des électrons au lieu de les gagner. Compte tenu de sa configuration électronique et d'autres aspects, vous pouvez perdre un ou deux électrons, devenant de cupros+, O Cuprico, Cu2+, respectivement.
Le Cucion Cu+ Il a un moins d'électron (29p<28e), y el Cu2+ a perdu deux électrons (29p<27e).
gaz nobles
Les gaz nobles (He, Ne, Ar, Kr, Xe, RN), sont l'un des rares éléments qui existent sous la forme de leurs atomes neutres. Ses nombres atomiques sont: 2, 10, 18, 36, 54 et 86, respectivement. Ils ne gagnent pas ou ne perdent pas d'électrons; Bien que, Xenon, Xe, puisse former des composés avec du fluor et perdre des électrons.
Les alliages de métaux
Les métaux sont protégés contre la corrosion peuvent maintenir leurs atomes neutres, unis par des liaisons métalliques. Dans les alliages, des solutions en métal solide, les atomes restent (principalement) neutres. En laiton, par exemple, il existe des atomes neutres de Cu et Zn.
Les références
- Qu'est-ce qu'un atome neutre? Récupéré de: introduction à la physique.com
- Exemple d'atomes non neutres. Science. Récupéré de: science.com

