Structure du toluène, propriétés, utilisations, obtention
- 3757
- 683
- Mlle Ambre Dumont
Il Toluène C'est un hydrocarbure aromatique dont la formule condensée est C6H5Ch3 ou phch3 Et cela se compose d'un groupe méthyle (ch3) avec un anneau benzénique ou un groupe phényle (pH). Il se trouve naturellement dans le pétrole brut, dans le charbon, dans les émanations volcaniques et dans certains arbres, comme le Tolú de América au sud.
Ce solvant d'odeur caractéristique est principalement utilisé comme matière première industrielle et comme diluant de peinture. Il est également utilisé dans l'élimination des parasites présents chez les chats et les chiens, comme les ascarides et les anylostomes.
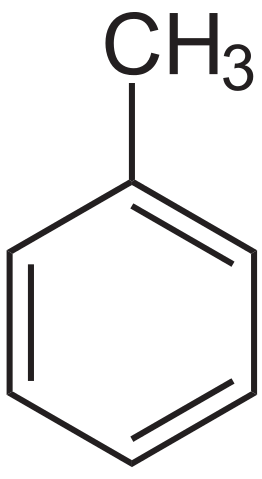
 Formule structurelle du toluène. Source: Neurotoger via Wikipedia.
Formule structurelle du toluène. Source: Neurotoger via Wikipedia. Le toluène a été isolé pour la première fois par Pierre-Joseph Pelletier et Philippe Walter, en 1837, d'huile de pin. Par la suite, Henri Etienne Sainte-Claire Deville, en 1841, l'a isolée du baume Tolú et a souligné que son produit était similaire à celle précédemment isolée. En 1843, Berzelius l'a baptisé comme toluin.
La plupart du toluène est obtenu en tant que produit latéral ou secondaire dans les processus de production de gaz et la conversion du charbon en coke. Il est également produit par des réactions réalisées en laboratoire, par exemple la réaction de benzène avec le chlorure de méthyle.
[TOC]
Structure
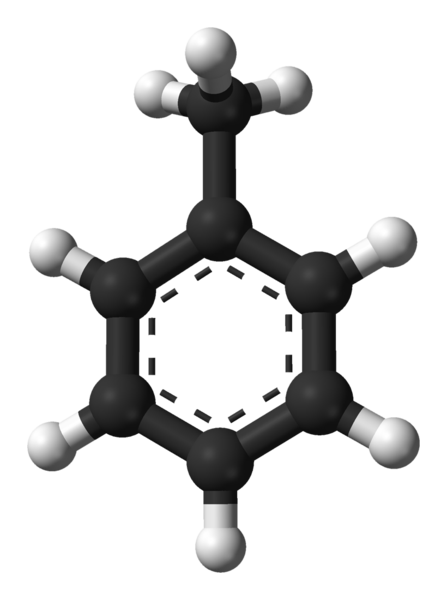 Structure moléculaire du toluène. Source: Ben Mills via Wikipedia.
Structure moléculaire du toluène. Source: Ben Mills via Wikipedia. Dans l'image supérieure, nous avons la structure moléculaire du toluène représenté par un modèle de sphères et de barres. Notez qu'il ressemble exactement à la formule structurelle indiquée, avec la différence qu'il ne s'agit pas complètement d'une molécule plate.
Au centre de l'anneau de benzène, qui dans ce cas peut être considéré comme un groupe phényle, le pH, son caractère aromatique est mis en évidence à travers les lignes pointillées. Tous les atomes de carbone ont une hybridation SP2, Sauf pour le groupe CHO3, dont l'hybridation est SP3.
C'est pour cette raison que la molécule n'est pas complètement plate: les hydrogènes Cho3 Ils sont situés à différents angles du plan d'anneau benzénique.
Peut vous servir: constante d'ionisationLe toluène est une molécule apolaire, hydrophobe et aromatique. Ses interactions intermoléculaires sont basées sur les forces dispersives de Londres et dans les interactions dipolo-dipolo, car le centre de l'anneau est «chargé» de densité électronique fournie par le CH3; Tandis que les atomes d'hydrogène ont une faible densité électronique.
Par conséquent, le toluène a plusieurs types d'interactions intermoléculaires qui maintiennent les molécules de leur cohésive liquide. Cela se reflète dans son point d'ébullition, 111 ° C, ce qui est élevé étant donné qu'il s'agit d'un solvant apolaire.
Propriétés
Apparence physique
Liquide incolore et transparent
Masse molaire
92 141 g / mol
Odeur
Doux, acre et similaire à celui du benzène
Densité
0,87 g / ml à 20 ºC
Point de fusion
-95 ºC
Point d'ébullition
111 ºC
Solubilité
Le toluène a une solubilité méprisable dans l'eau: 0,52 g / L à 20 ° C. Cela en raison de la différence de polarités entre le toluène et l'eau.
D'un autre côté, le toluène est soluble, ou dans ce cas miscible, avec de l'éthanol, du benzène, de l'éther éthylique, de l'acétone, du chloroforme, de l'acide acétique glaciaire et du disulfure de carbone; c'est-à-dire qu'il est mieux solubilisé dans des solvants moins polaires.
Indice de réfraction (nD)
1497
Gelée
0,590 cp (20 ºC)
point d'allumage
6 ºC. Le toluène doit être manipulé dans des camps d'extraction de gaz et aussi loin que possible de toute flamme.
Densité de vapeur
3.14 dans la relation aérienne = 1. C'est-à-dire que leurs vapeurs sont trois fois plus denses que l'air.
La pression de vapeur
2.8 kPa à 20 ° C (environ 0.27 atm).
Température d'auto-signification
480 ° C
Décomposition
Peut réagir vigoureusement avec des matériaux oxydants. Lorsqu'il est chauffé à la décomposition, il émet un acre et de la fumée irritante.
Tension superficielle
29.46 MN à 10 ºC
Moment dipolaire
0,36 D
Réactivité
Le toluène est sujet à la chloration pour produire de l'ortho-chlorotoluène et du para-cllorotoluène. Il est également facile de nitrifier pour produire du nitrotoluène, qui est la matière première des colorants.
Peut vous servir: poids atomiqueUne partie du toluène est combinée avec trois parties d'acide nitrique pour provoquer le trinitrotoluène (TNT): l'un des explosifs les plus connus.
De même, le toluène éprouve la sulfonation pour générer des acides O-Toluen-sulfonic et P-Toluen-sulfonic, qui sont la matière première pour la fabrication de colorants et de saccharine.
Le groupe méthyle du toluène subit une perte d'hydrogène en raison de l'action d'une base forte. Le groupe méthyle est également sensible à l'oxydation, donc il réagit avec le permanganate de potassium pour provoquer l'acide benzoïque et benzaldéhyde d'origine.
Applications
Industriels
 Le TNT, l'explosif le plus symbolique de tous, se produit par le toluène comme la principale matière première. Source: Pixabay.
Le TNT, l'explosif le plus symbolique de tous, se produit par le toluène comme la principale matière première. Source: Pixabay. Le toluène est utilisé dans l'élaboration des peintures, des diluants des peintures, des ongles polis, des adhésifs ou des gencives de pâte, des laques, des encres, du nylon, du plastique, de la mousse de polyuréthane, la plupart des huiles, des organes de vinyle, des médicaments, des colorants, des parfums, des explosifs (TNT).
De la même manière, le toluène est utilisé sous forme de toluenosulfonados dans la fabrication de détergent. Le toluène est également d'une grande importance dans la fabrication de ciments en plastique, de caves cosmétiques, d'antigel, d'encres, d'asphalte, de marqueurs permanents, de ciments de contact, etc.
Solvant et diluant
Le toluène est utilisé dans la dilution des peintures, ce qui facilite son application. Il est utilisé pour dissoudre les bords des kits en polystyrène, permettant ainsi l'union des pièces qui constituent des modèles d'aéronefs à l'échelle. De plus, il est utilisé dans l'extraction des produits naturels des plantes.
Le toluène est un solvant à encre utilisé dans le trou gravé. Les ciments mélangés avec du caoutchouc et du toluène sont utilisés pour couvrir un grand nombre de produits. De même, le toluène est utilisé comme solvant dans les encres imprimées, les laques, les tanners en cuir, la colle et les désinfectants.
Peut vous servir: absorbant molaireEt encore plus intéressant, le toluène est utilisé comme solvant de nanomatériaux de carbone (tels que les nanotubes) et de fullerrenos.
Autres
Un mélange de benzène, de toluène et de xylène (BTX) est ajouté à l'essence pour augmenter son octane. Le toluène est un additif du gaz d'avion et de la réserve d'octane élevé. Il est également utilisé dans l'élaboration de l'ALENA.
Le toluène aide à l'élimination de certaines espèces d'Ascárides et d'Anquilostomos, ainsi que de tenias qui sont des parasites de chats et de chiens.
Obtention
La majeure partie du toluène est obtenue à partir de produits distillés à partir d'huile brute, générée pendant la pyrolyse d'hydrocarbures (fissuration à la vapeur). La réforme catalytique des vapeurs d'huile représente 87% des toluènes produits.
9% supplémentaires du toluène provenant de l'essence pyrolyse produite lors de la fabrication d'éthylène et de propylène.
Le goudron de Hulla de fours à coke contribue 1% du toluène produit, tandis que les 2% restants sont obtenus comme sous-produit de la fabrication de l'étirement.
Effets préjudiciables
Le toluène est un solvant qui est inhalé pour devenir haut, car il a une action narcotique qui affecte le fonctionnement du système nerveux central. Le toluène entre dans le corps pour l'ingestion, l'inhalation et l'absorption à travers la peau.
À un niveau d'exposition de 200 ppm, l'excitation, l'euphorie, les hallucinations, les perceptions déformées, les maux de tête et les étourdissements peuvent se produire. Alors que des niveaux plus élevés d'exposition au toluène peuvent produire une dépression, une somnolence et une stupeur.
Lorsque l'inhalation dépasse une concentration de 10.000 ppm, est capable de produire la mort de l'individu en raison d'une insuffisance respiratoire.
Les références
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. (dixe Édition.). Wiley Plus.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Morrison et Boyd. (1987). Chimie organique. (Cinquième édition). Addison-wesley iberoamericana.
- Centre national d'information sur la biotechnologie. (2020). Toluène. Base de données PubChem., CID = 1140. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Wikipédia. (2020). Toluène. Récupéré de: dans.Wikipédia.org
- Boîte à outils d'ingénierie, (2018). Toluène - Propriétés thermophysiques. [En ligne] Récupéré de: EngineeringToolbox.com
- Vedantu. (s.F.). Toluène. Récupéré de: Vedantu.com
- « Formule et équations d'interférence destructrices, exemples, exercice
- Structure de polyvinylpirrolidone, propriétés, utilisations, effets secondaires »

