Caractéristiques de la tyrosine, structure, fonctions, avantages
- 4162
- 1198
- Adam Mercier
La Tyrosine (Tyr, Y) est l'un des 22 acides aminés qui composent les protéines de toutes les cellules présentes dans les êtres vivants. Contrairement à d'autres acides aminés tels que la valine, la treonine, le tryptophane, la leucine, la lysine et autres, la tyrosine est un acide aminé "conditionnellement" essentiellement essentiellement essentiel.
Le nom "Tyrosine" dérive du mot grec "tournage", Ce qui signifie le fromage, car cet acide aminé a été découvert pour la première fois dans cette nourriture. Le terme a été inventé en 1846 par Liebig, qui a mélangé le fromage avec de l'hydroxyde de potassium et a obtenu un composé inconnu, à peine soluble dans l'eau.
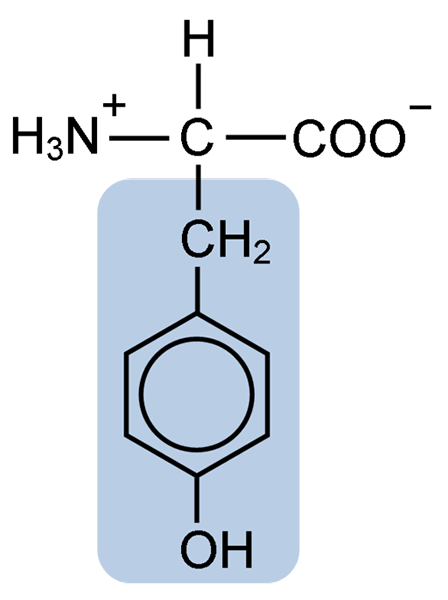
 Structure chimique de l'acide aminé de la tyrosine (Source: Clavecin [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] via Wikimedia Commons)
Structure chimique de l'acide aminé de la tyrosine (Source: Clavecin [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] via Wikimedia Commons) Après la description initiale, d'autres chercheurs tels que Warren de la Rue et Hinterberger obtenus à partir de protéines coco-insectes et de cornes, respectivement. Sa séparation de l'hydrolyse d'autres protéines avec de l'acide chlorhydrique a été décrite en 1901 par Mörner.
Généralement, cet acide aminé est obtenu chez les mammifères grâce à l'hydroxylation de la phénylalanine, bien qu'il soit également absorbé par l'intestin des protéines consommées avec des aliments.
La tyrosine a de multiples fonctions dans le corps humain et parmi celles-ci les plus pertinentes sont peut-être celles du substrat pour la production de neurotransmetteurs et d'hormones telles que l'adrénaline et l'hormone thyroïdienne.
[TOC]
Caractéristiques
La tyrosine pèse environ 180 g / mol et son groupe de chaîne de r ou latérale a une constante de 10 dissociation 10.07. Son abondance relative dans les protéines cellulaires ne dépasse pas 4%, mais a de multiples fonctions essentielles pour la physiologie humaine.
Cet acide aminé appartient au groupe d'acides aminés aromatiques, dans lesquels la phénylalanine et le tryptophane sont également. Les membres de ce groupe ont des anneaux aromatiques dans leurs chaînes R r ou latérales et, généralement, ils sont des acides aminés hydrophobes ou apolaires.
Comme le tryptophane, la tyrosine absorbe la lumière ultraviolette et est l'un des déchets d'acides aminés responsables de l'absorbance de la lumière à 280 nm de nombreuses protéines, il est donc utile pour sa caractérisation.
Il est considéré comme un acide aminé "conditionnellement" essentiel car sa biosynthèse dans l'être humain dépend de la phénylalanine, un acide aminé essentiel. Si le corps satisfait à ses exigences quotidiennes de la phénylalanine, la tyrosine peut être synthétisée sans problème et n'est pas un acide aminé limitant.
Cependant, si le régime fait défaut de phénylalanine, le corps aura non seulement un déséquilibre de cet acide aminé, mais aussi de la tyrosine. Il est également important de souligner que la réaction de la synthèse de la tyrosine de la phénylalanine n'est pas réversible, donc la tyrosine ne peut pas répondre aux besoins cellulaires de la phénylalanine.
La tyrosine appartient également au groupe d'acides aminés avec deux fonctions dans la production d'intermédiaires métaboliques glucogéniques et cétogènes, qui participent à la synthèse du glucose pour le cerveau et à la formation de corps cétone dans le foie.
Structure
Comme le reste des acides aminés, la tyrosine ou l'acide propionique β-parahydroxyphényl-α-aminé, c'est un acide α-aminé qui a un atome de carbone central, appelé carbone α et qui est chiral, car il est lié à quatre atomes ou molécules de substituant différents.
Ce carbone étrange est lié à deux groupes caractéristiques d'acides aminés: un groupe amino (NH2) et un groupe carboxyle (COOH). Il partage également l'une de ses liais.
Dans le cas de la tyrosine, ce groupe se compose d'un anneau aromatique associé à un groupe hydroxyle (OH), qui lui donne la capacité de former des ponts d'hydrogène avec d'autres molécules et qui lui donne des caractéristiques fonctionnelles essentielles pour certaines enzymes.
Il peut vous servir: barorececepteursLes fonctions
La tyrosine est une composante fondamentale de nombreuses protéines avec une grande diversité d'activités et de fonctions biologiques.
Chez l'homme et d'autres mammifères, cet acide aminé est mis à profit dans les tissus nerveux et rénaux pour la synthèse de la dopamine, de l'adrénaline et de la noradrénaline, trois catécholaminergiques liés aux neurotransmetteurs liés à la plus grande importance pour le fonctionnement du corps pour le corps corporel.
Il est également essentiel pour la synthèse de protecteurs de rayonnement ultraviolet (UV) tels que la mélanine; de certains analgésiques tels que les endorphines et les molécules antioxydantes telles que la vitamine E.
De même, cet acide aminé sert à la synthèse des hormones de tiramine, d'octopamine et de thyroïde par l'organisation d'iode dans le résidu tyrosine de la thyoglobuline.
Le tiramine est une molécule vasoactive trouvée dans le corps humain et l'octopamine est une amine liée à.
Toutes ces fonctions de la tyrosine sont possibles grâce à son objet à partir des protéines du régime ou par hydroxylation de la phénylalanine avec le foie comme principal système d'approvisionnement systémique dudit acide aminé.
Fonctions dans les plantes
La tyrosine et certains des intermédiaires générés lors de leur biosynthèse nourrissent les voies de biosynthèse de métabolites spécialisés dans la défense, dans l'attraction des pollinisateurs, dans le transport électronique et le soutien structurel.
Biosynthèse
Dans l'être humain, la tyrosine est obtenue à partir du régime alimentaire ou synthétisé en une seule étape par des cellules hépatiques de la phénylalanine, un acide aminé essentiel, par la réaction catalysée par le complexe enzymatique de la phénylalanine hydroxylase.
Ce complexe a une activité d'oxygénase et n'est présent que dans le foie des humains ou d'autres mammifères. La réaction de synthèse de la tyrosine implique donc le transfert d'un atome d'oxygène à la position pour de l'anneau aromatique de la phénylalanine.
Cette réaction se produit en même temps qu'une molécule d'eau se forme en raison de la réduction d'un autre atome d'oxygène moléculaire et que la puissance de réduction est apportée directement par un NADPH conjugué à une molécule de tétrahydropterine, qui est similaire à l'acide folique.
Biosynthèse dans les plantes
Dans les plantes, la tyrosine est synthétisée de Novo En aval de la route «Shikimato», qui nourrit d'autres voies biosynthétiques d'autres acides aminés aromatiques tels que la phénylalanine et le tryptophane.
Dans ces organismes, la synthèse est basée sur un composé connu sous le nom de "corismato", qui est le produit final de la route Shikimato et, en outre, le précurseur commun pour tous les acides aminés aromatiques, certaines vitamines et hormones végétales.
Le corétique est converti en préface par l'action catalytique de l'enzyme corétique de Mutasa et c'est la première étape "engagée" dans la synthèse de la tyrosine et de la phénylalanine chez les plantes.
La prédéate est convertie en tyrosine par une décarboxylation oxydative et une transamination, qui peut se produire dans n'importe quel ordre.
Dans l'une des routes biosynthétiques, ces étapes peuvent être catalysées par des enzymes spécifiques appelées déshydrogénase spécifique au préfénate (PDH) (qui convertit la préface en 4-hydroxyphénylpyphénylpyruvate (HPP)) et le tyrosine aminotransférase (qui produit la tyrosine à partir du HPP), du HPP), respectivement.
Un autre chemin de synthèse de la tyrosine à partir de la préface implique la transamination du prédéniate à un acide aminé non protéinogène appelé l-arogéné, catalysé par l'enzyme linéate d'aminotransférase.
Le L-arogénat est par la suite soumis à une décarboxylation oxydative pour former la thyroxine, une réaction dirigée par une déshydrogénase spécifique à l'arogée enzymatique, également connue sous le nom d'ADH.
Les plantes utilisent préférentiellement l'itinéraire de l'arène, tandis que la plupart des microbes synthétisent la tyrosine du HPP dérivé du prédédésat.
Régulation
Comme c'est vrai pour la plupart des voies biosynthétiques des acides aminés, les plantes ont un système strict de régulation de la synthèse des acides aminés aromatiques, y compris la tyrosine.
Peut vous servir: Monster délicieux: caractéristiques, habitat, soins, propriétésDans ces organismes, la régulation se produit à plusieurs niveaux, car les mécanismes qui contrôlent la route Shikimato contrôlent également la production de tyrosine, une route pour laquelle il y a aussi leurs propres mécanismes de régulation.
Cependant, les besoins en tyrosine et, par conséquent, la rigidité dans la régulation de leur biosynthèse, sont spécifiques à chaque espèce végétale.
Dégradation
La dégradation ou le catabolisme de la tyrosine entraîne la formation de fumarate et d'acétoacétate. La première étape de cette voie consiste à la conversion de l'acide aminé en 4-hydroxyphénylpypate par une enzyme cytosolique connue sous le nom d'aminotransférase tyrosine.
Cet acide aminé peut également être transaminé dans les mitochondries des hépatocytes par une enzyme aspartate d'aminotransférase, bien que cette enzyme ne soit pas très importante dans des conditions physiologiques normales.
Grâce à la dégradation de la tyrosine, le succinyl-acétoacétate peut se produire, qui peut être décarboxylé pour acétate de succinyle. Le succinyl-acétate est l'inhibiteur enzymatique le plus puissant responsable de la synthèse du groupe Hemo, la 5-aminolévuline acide déshydratase.
Synthèse d'adrénaline et de noradrénaline
Comme mentionné, la tyrosine est l'un des principaux substrats de la synthèse de deux neurotransmetteurs très importants pour le corps humain: l'adrénaline et la norépinéphrine.
Ceci est initialement utilisé par une enzyme connue sous le nom de tyrosine hydroxylase, capable d'ajouter un groupe hydroxyle supplémentaire à l'anneau aromatique du groupe RI tyrosine R, qui forme le composé connu sous le nom de DOPA.
La DOPA donne naissance à la dopamine une fois qu'elle est traitée enzymatiquement par une enzyme dopa decboxilas.
La dopamine est ensuite convertie en nororprénaline par l'action de l'enzyme de dopamine β -oxydase, qui catalyse l'ajout d'un groupe hydroxyle à -ch qui faisait partie du groupe R de la tyrosine et qui fonctionnait comme un "pont" entre l'anneau aromatique et carbone α.
L'adrénaline dérive de la noradrénaline par l'action de la phénythanolamine N-méthyltransférase, qui est responsable du transfert dépendant de la S-adénosyl-métitionine d'un groupe méthyle (-CH3) au groupe amino libre de noradréphrine.
Aliments riches en tyrosine
Comme mentionné ci-dessus, la tyrosine est un acide aminé "conditionnellement" essentiel, car il est synthétisé dans le corps humain par hydroxylation de la phénylalanine, un acide aminé essentiel.
Par conséquent, si la consommation de phénylalanine couvre les exigences du corps, la tyrosine n'est pas un facteur limitant pour le fonctionnement normal des cellules. La tyrosine, cependant, est également acquise à partir de protéines qui sont consommées avec des aliments quotidiens.
Certaines études rapportent que l'apport quotidien minimum de la tyrosine et de la phénylalanine devrait être comprise entre 25 et 30 mg par kilogramme, donc une personne moyenne devrait consommer plus ou moins 875 mg de tyrosine par jour.
Les aliments avec une teneur en tyrosine plus élevée sont le fromage et le soja. Parmi ceux-ci sont également le bœuf, l'agneau, le porc, le poulet et le poisson.
Certaines graines et noix tels que les noix confèrent également des contributions importantes à cet acide aminé, ainsi que des œufs, des produits laitiers, des céréales et des céréales.
Avantages de votre apport
La tyrosine est couramment consommée sous forme de compléments alimentaires ou nutritionnels, en particulier pour le traitement de la pathologie appelée phénylcetonurie, subis par les patients incapables de traiter correctement la phénylalanine et, par conséquent, ne produisent pas de tyrosine.
Il peut vous servir: fonction relationnelleOn pense qu'une augmentation de la quantité de tyrosine consommée par jour peut améliorer les fonctions cognitives liées à l'apprentissage, à la mémoire et à l'état d'alerte dans des conditions stressantes, car son catabolisme est lié à la synthèse de l'adrénaline et des neurotransmetteurs norgénéniaux.
Certaines personnes prennent des comprimés riches en tirosine pour rester vigilants pendant la journée s'ils ont perdu une quantité importante d'heures de sommeil.
Comme cet acide aminé participe à la formation de l'hormone thyroïdienne, sa consommation peut avoir des effets positifs sur la régulation métabolique systémique.
Troubles de la carence
L'albinisme et l'alcaptonurie sont deux pathologies liées au métabolisme de la tyrosine. La première condition est liée à la synthèse défectueuse de la mélanine de la tyrosine et la seconde a à voir avec les défauts de la dégradation de la tyrosine.
L'albinisme se caractérise par le manque de pigmentation dans la peau, c'est-à-dire que les patients qui en souffrent ont des cheveux blancs et une peau rosée, car la mélanine est le pigment responsable de la fourniture de ces structures.
Cette pathologie a à voir avec une carence en tyrosinase spécifique des mélanocytes, qui est responsable de la conversion de la tyrosine en dopa-quinone, un intermédiaire dans la synthèse de la mélanine.
Les symptômes de l'alcaptonurie sont évidents comme une pigmentation d'urine exagérée (sombre) et une arthrite tardive du développement.
Autres pathologies métaboliques
De plus, il existe d'autres troubles liés au métabolisme de la tyrosine, parmi lesquels sont:
- Tyrosinémie héréditaire de type I: caractérisée par une dégénérescence hépatique progressive et une dysfonction rénale
- Tyrosinémie héréditaire du syndrome de type II ou Richner-Hanhart: qui est évident comme une kératite et des lésions ampulaires dans la paume des mains et des semelles des pieds
- Tyrosinémie de type III: qui peut être asymptomatique ou présent sous forme de retards mentaux
- "Hawkinsinuria": caractérisé par l'acidose métabolique dans l'enfance et l'incapacité de prospérer en croissance
Il existe également d'autres défauts innés dans le métabolisme de la métrosine qui ont à voir avec les carences dans les enzymes responsables de leur dégradation, telles que l'hydroxylase tyrosine, en charge de la première étape de la synthèse de la dopamine à partir de la tyrosine.
Les références
- Aders Plimmer, R. (1908). La constitution chimique des protéines. Je suis parti. Londres, Royaume-Uni: Longmans, Green et Co.
- Chakrapani, un., Gissen, P., & McKiernan, P. (2012). Troubles du métabolisme de la tyrosine. Dans Désir métabolique inné: diagnostic et traitement (PP. 265-276).
- Kretchmer, n., Levine, S., McNamara, H., & Barnett, H. (1956). Certains aspects du métabolisme de la tyrosine chez les jeunes. Toi. Le développement du système d'oxydation de la tyrosine dans le foie humain. Le Journal of Clinical Investigation, 35(10), 1089-1093.
- Du, b., Zannoni, V., Laster, L., & Seegmiller, E. (1958). La nature du défaut dans le métabolisme de la tyrosine en Alkaptonurie. Journal of Biological Chemistry, 230, 251-260.
- Murray, R., Bender, D., Botham, K., Kennelly, P., Rodwell, V., & Weil, P. (2009). Biochimie illustrée de Harper (28e Ed.). McGraw-Hill Medical.
- Nelson, D. L., & Cox, M. M. (2009). Principes de lehninger de la biochimie. Éditions Omega (5e Ed.).
- Schenck, C. POUR., & Maeda, h. POUR. (2018). Biosynthèse de la tyrosine, métabolisme et catabolisme chez les plantes. Phytochimie, 149, 82-102.
- Slominski, un., Zmijewski, m. POUR., & Paweley, J. (2012). L-tyrosine et L-di-dihydroxyphénylalanine comme régulateurs hormonaux des fonctions de mélanocytes. Recherche de cellules pigmentaires et de mélanome, 25(1), 14-27.
- Van de, g. (2018). Ligne de santé. Récupéré le 16 septembre 2019 de www.Healthline.com
- Web md. (n.d.). Récupéré le 15 septembre 2019 de www.Webmd.com
- Whitbread, D. (2019). Mes données alimentaires. Récupéré le 15 septembre 2019 de www.Myfooddata.com
- « Fonctions d'assistance sociale, types, établissements au Mexique
- Méthode Tachtenberg Qu'est-ce que, des exemples »

