Tioles
- 4067
- 974
- Mlle Ambre Dumont
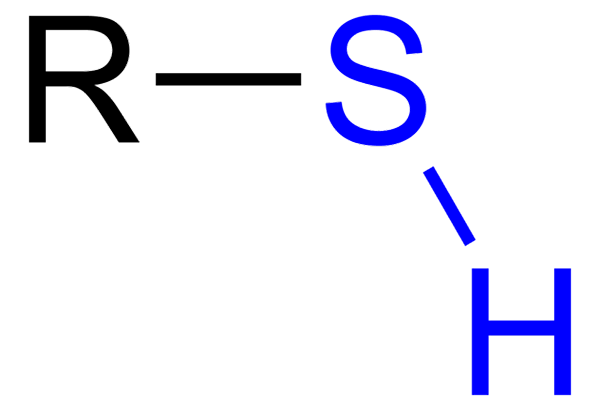
Les Tioles Ce sont des composés organiques qui ont un groupe SH, appelé groupe tiol ou sulfihydrilo. Sa formule générale est RSH, pouvant représenter R à un loyer, un aryle ou un autre groupe chimique. La caractéristique distinctive des thioles est sa forte odeur puante.
Certains thioles sont utilisés pour transmettre leur odeur de gaz combustible, afin de détecter une fuite de ces gaz, qui étant donné leur caractéristique peut être d'un grand danger. Les tioles sont similaires aux alcools, car ils ont un groupe OH, tandis que les thioles a sh.
 Tiol avec groupe de sulfhydrillo bleu
Tiol avec groupe de sulfhydrillo bleu Cependant, ils ont à leur tour plusieurs différences: le groupe OH est plus polaire que le groupe SH, et le soufre est un atome plus petit que l'oxygène et moins électronégatif.
Cela détermine que les molécules thioles ne forment pas de liaisons hydrogène ou d'eau ou parmi elles. Par conséquent, la solubilité des thioles dans l'eau est faible et son point d'ébullition est inférieur à celui des alcools avec une chaîne de carbones similaires.
Les tioles sont particulièrement utiles et fréquentes dans les systèmes biochimiques, car plusieurs correspondent à des biomolécules, comme la coenzyme pour. Sa liaison S-H est plus acide que O-H, plus facile à briser, et également plus facile à remplacer ou à remplacer d'autres fragments moléculaires dans de nombreuses synthèses organiques de soufre.
[TOC]
Propriétés des tioles
 L'arôme malodorant des contreforts est principalement composé de thioles
L'arôme malodorant des contreforts est principalement composé de thioles Généralités
Le groupe OH d'alcools et le groupe SH des Tioles partagent un ensemble de propriétés physiques et chimiques pour appartenir à l'oxygène et au soufre au même groupe chimique du tableau périodique (via le groupe).
Loa tioéters, uniocétaux et thioésters, qui sont analogues aux composés chimiques formés par des alcools, tels que les éthers, les acétals et les esters. Cependant, les liens S-H et O-H présentent certaines différences qui se refléteront dans les propriétés des thioles et des alcools.
Odeur
Une caractéristique des thioles à faible poids moléculaire est son odeur désagréable, similaire à l'ail et à l'oignon. Cette odeur est d'une telle ampleur que l'odeur humaine a un seuil d'une partie du thiol pour dix milliards de parties d'air.
L'étanotiol est ajouté au gaz naturel comme mesure de sécurité, pour détecter toute échappement inflammable mais des toilettes lui-même. L'odeur des thioles diminue en augmentant le nombre de carbones de leur chaîne, car la volatilité et la proportion de soufre tiol diminue.
Peut vous servir: phosphate d'ammonium: structure, propriétés, obtention, utilisationsPoint d'ébullition et solubilité
Le lien S-H des thioles a un moment dipolaire de moins que le lien O-H des alcools. De plus, l'atome de soufre est de plus en plus petit et plus petit que l'atome d'oxygène.
Cela détermine que les molécules de thioles ne peuvent pas former des liaisons hydrogène avec de l'eau ou parmi eux, provoquant une différence entre les propriétés physiques des thioles et des alcools. Par exemple: métanotiol (CHO3Sh) a un point d'ébullition de 6 ºC, tandis que le méthanol (CHO3Oh) bouillonne à 65 ° C.
Par conséquent, à température ambiante (25 ºC), le méthanol est un liquide et le métanotiol est un gaz.
En résumé: les thioles ont un point d'ébullition inférieur que les alcools correspondants présentés. Pour les mêmes raisons, la solubilité des thioles dans l'eau et dans d'autres solvants polaires est très faible. Pendant ce temps, les alcools de faible poids moléculaire sont très solubles dans l'eau.
Réactivité
La liaison S-H est plus faible que la liaison O-H, donc la liaison S-H se dissocie plus facilement, ce qui rend les thiols des acides forts que les alcools. La plupart des alcools ont une PKA entre 16 et 18 ans, tandis que les thioles ont un PKA autour de 11.
Cela permet aux thioles-): Un agent nucléophile très fort.
Le groupe SH peut s'oxyder pour former des liens de disulfures (-s-s-) qui sont présents dans l'oxydation du glutathion: un thiol présent dans les cellules et a une fonction antioxydante.
Le bromo ou d'autres halogènes, ainsi que l'oxygène, peuvent agir sur un thiol pour former des ponts disulfure:
2 Rsh + Br → R-S-S-R '+2 HBR
Les composés RSSR sont appelés sulfures organiques et alkiiles, R2S.
D'un autre côté, de forts agents oxydants, tels que l'hypochlorite de sodium et le peroxyde d'hydrogène, peuvent agir sur les thioles pour provoquer des acides sulfoniques:
Rsh + H2SOIT2 → RSO3H +3 h2SOIT
Nomenclature
La nomenclature IUPAC pour les thioles est très similaire à celle des alcools: le nom de l'alcano dont le suffixe `` tiol '' lui est ajouté.
Ainsi, par exemple, le thattan dérivé de Stano est appelé 1-butanotiol, ch3Ch2Ch2Ch2Sh, indiquant avec le nombre la position du groupe SH dans les carbones de la chaîne.
Peut vous servir: cation: formation, différences avec l'anion et des exemplesDe la même manière, il y a une autre nomenclature, encore une fois, similaire à celle des alcools: le mot «alcool» est remplacé par «Mercaptan» au nom des alcools. Par exemple, Cho3Sh, analogique à l'alcool méthylique, ch3Oh, est appelé méthyl ou mercaptan mercaptan.
Un autre exemple serait Cho3Ch2Ch (sh) ch3, appelé 2-butanotiol, marchand secbutilique ou marchandise secbutil. C'est-à-dire que l'accent est mis sur l'identité de R dans la formule RSH. Par conséquent, les autres normes de nomenclature pour les alcools sont également remplies pour les thioles.
Et enfin, lorsque le groupe SH est présent dans une structure plus grande ou où les groupes les plus importants prédominent, le préfixe Sulfihydrilo ou Mercapto est utilisé.
Par exemple, composé ch3Ch2Ch (sh) coch3 Il s'appelle 3-Mercapto-2-Penona. Notez que le SH a moins de priorité que les groupes oxygénés (à l'exception de l'éther), donc les chiffres mineurs correspondent à lui.
La synthèse
Une méthode de synthèse des thioles consiste en la réaction du tiota avec un halogénure d'alkyle, qui produit un sel intermédiaire d'isotiouron. Ceci est hydrolysé par l'hydroxyde de sodium pour obtenir du thiol et de l'urée.
Le ch3SH est préparé industriellement par réaction de sulfure d'hydrogène avec du méthanol, en présence de catalyseurs acides:
Ch3OH + H2S → ch3Sh + h2SOIT
Dans une autre méthode de production, un halogénure d'alkyle est réagi avec Hydrosulfuro de sodium:
Rx + Nash → Rsh + Nax
Applications
Fixation enzymatique liée aux nanoparticules
Les tioles sont utilisées comme ponts pour rejoindre des complexes nanoparticules en ézyme aux électrodes en or. Par exemple, les thioles sont utilisés pour la fixation du complexe nanoparticules-uricasa, une enzyme qui intervient dans la conversion de l'acide urique en allantoine.
Tiol-pas de réaction
Il s'agit d'une réaction organique entre un tiol et un alcène, appelant une réaction de «clic»; Que parmi les autres caractéristiques, il s'agit d'une réaction à haute performance, une large portée, qui crée éliminable par les produits par des méthodes non chromatographiques, et qui est également facile à effectuer.
La réaction thiol-pas a des applications dans la synthèse de Tioazúcar: sucre présent dans le salicinol, un inhibiteur de l'α-glycosidase. Le salicinol a été isolé des plantes utilisées au Sri Lanka et en Inde dans le traitement du diabète.
De plus, la réaction thiol-pas est utilisée dans la chimie des glucides, des polymérisations, de la chimie de surface, de la chimie de la synthèse et de la chimie des peptides.
Peut vous servir: point de congélation: comment le calculer et les exemplesOdorants
 Le gaz de cuisine est des toilettes, mais grâce à sa composition de thioles à faible poids moléculaire, il a une odeur distinctive
Le gaz de cuisine est des toilettes, mais grâce à sa composition de thioles à faible poids moléculaire, il a une odeur distinctive Les thioles aliphatiques de faible poids moléculaire sont incorporés dans les gaz naturels de sorte que leur forte odeur sert d'avertissement face à une évasion ou à une fuite de gaz.
Médecine
Pénicilamine (c5HonzeNON2S) Il s'agit d'un médicament utilisé dans le traitement de la maladie de Wilson et de la polyarthrite rhumatoïde.
Et le captopril (c9HquinzeNON3S), en revanche, il est utilisé dans le traitement de l'hypertension artérielle et des maladies cardiaques congestives.
Les deux sont des exemples de thioles avec des applications médicinales.
Biologique
Des groupes de tioles sont présents, entre autres composés ayant une fonction biologique, dans la cystéine, la coenzyme A et le glutathion.
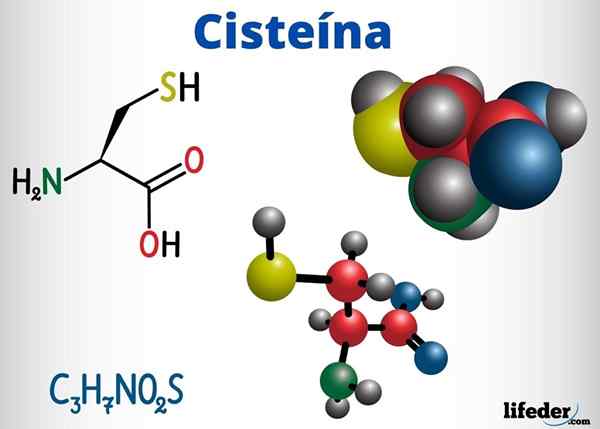
La cystéine est un acide aminé capable de former des ponts de disulfure dans sa chaîne de protéines, donc responsable de la structure tertiaire d'une protéine. Il peut également former des ponts de disulfure entre différentes chaînes de protéines, provoquant la structure quaternaire des protéines.
La cystéine est située dans les centres actifs de nombreuses enzymes et a également une action antioxydante.
Le glutathion est une action intracellulaire antioxydante très importante, conférant une protection aux cellules et aux macromolécules qui le composent.
La coenzyme A, en revanche, est un thiol qui intervient dans la synthèse et l'oxydation des acides gras. De plus, la coenzyme sous la forme d'acétylcoenzyme A, intervient au début du cycle de l'acide citrique ou du cycle de Krebs.
Exemples
Enfin, certains noms de thioles seront répertoriés accompagnés de leurs formules moléculaires:
-Acide tioacétique (c2H4TOI)
-Coenzyme A (Cvingt-et-unH36N7SOIT16P3S)
-Glutation réduite (CdixH17N3SOIT6S)
-Cystéine (c3H7NON2S)
-Mercaptanol (c2H6TOI)
-Métanotiol (ch3Sh)
-1-propanotiol (c3H7Sh)
-Butanotiol (c4H 9Sh)
-Tiofénol ou tiomérosal (c6H6S)
-Pomelo Mercaptano (CdixH18S)
-Hexadécanotiol (c6H3. 4S)
-Pénicillamine (c6HonzeNON2S)
-Captopril (c9HquinzeNON3S)
-Étanotiol (c2H6S)
-2-propénétiol (c3H6S)
-Α-lipoïque ou lipoamide (c8H14SOIT2S2). C'est un disulfure cyclique.
Les références
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. (dixe Édition.). Wiley Plus.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Morrison et Boyd. (1987). Chimie organique. (Cinquième édition). Addison-wesley iberoamericana.
- Wikipédia. (2020). Thiol. Récupéré de: dans.Wikipédia.org
- Docteur. Dietmar Kennepohl et al. (13 septembre 2020). Thiols et sulfures. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- Les éditeurs d'Enyclopaedia Britannica. (2020). Thiol. Récupéré de: Britannica.com
- Nolan MD et Scanlan EM (2020) Applications de la chimie thiol-ène pour la science des peptides. Devant. Chem. 8: 583272. Doi: 10.3389 / FCHEM.2020.583272
- Docteur. Carl C. Wamser. (1999). Chapitre 9: Alcools et thiols. Récupéré de: Web.Pdx.Édu

