Formation de tiocyanate, structure, types, utilisations
- 796
- 130
- Noa Da silva
Il Tiocianato C'est un anion inorganique dont la formule est SCN-. C'est ce qui est connu de Pseudohalogogenuro, car son comportement chimique ressemble à celui d'halogénuros, c'est-à-dire du fluor, du chlorure, etc. Il est également connu sous le nom de Rodanida, bien que cela soit actuellement utilisé moins fréquemment.
Le tiocianate est une espèce curieuse, car elle est positionnée à la frontière entre la chimie organique et inorganique. Il fait parfaitement partie des composés organiques et inorganiques, ne variant que la façon dont il est lié ou l'interaction. Ce pseudohalogogogenuro a un fort lien biochimique avec les ions cyanure et leur métabolisme.
 Anion tiocyanate représenté par un modèle spatial complet. Source: Benjah-Bmm27 / Domaine public.
Anion tiocyanate représenté par un modèle spatial complet. Source: Benjah-Bmm27 / Domaine public. Dans l'image supérieure, il y a une représentation du SCN- Utilisation d'un modèle d'espace complet. La sphère jaune correspond à l'atome de soufre, tandis que le noir et le bleuâtre sont des atomes de carbone et d'azote, respectivement. Tiocianate a un frère oxygéné: Cyanato, OCN-, dans lequel l'atome de soufre est remplacé par un oxygène.
Le tiocianate de potassium, KSCN, est l'un des exemples les plus représentatifs pour ce pseudohalogogenuro. D'un autre côté, en chimie organique, il existe des tiocians dont les formules générales sont RSCN, comme le méthyl tiocianate, le cho3SCN.
[TOC]
Entraînement
Réaction entre le cyanure et le soufre
La formule SCN- vous permet d'apercevoir que sa synthèse est basée sur la réaction du cyanure, CN-, Avec une espèce qui donne des atomes de soufre. En effet, le cyanure peut bien réagir avec le soufre élémentaire, S8, ou avec les anions de tiosulfate, s2SOIT32- Pour produire du tiocyanate:
8 CN- + S8 → 8 SCN-
CN- + S2SOIT32- → SCN- + S2SOIT32-
Peut vous servir: Type de lien CO2Cependant, la deuxième réaction est catalysée par un système enzymatique composé de thiosulfate de sulfurtransférase. Notre corps a ces enzymes, et par conséquent, nous sommes en mesure de métaboliser les cyanures provenant de cyanoglucosides (glucides qui ont le groupe CN). De cette façon, le corps se débarrasse du CN nocif-, qui interfèrent avec les processus de respiration cellulaire.
Les tiocians sont dissous en salive et, dans une moindre mesure, dans le plasma. Leurs niveaux de concentration révèlent à quel point les individus sont exposés aux cyanures, soit en raison d'un apport excessif d'aliments qui le contiennent sous leur forme naturelle (noix, amandes, légumineuses, linazas, etc.), ou par inhalation prolongée de la fumée des cigarettes et du tabac.
Neutralisation de l'acide tiocian
Le SCN- Il peut être obtenu par neutralisation de sa forme acide: acide tiocianique, HSCN ou isotiocyanique, HNCS. Selon la base utilisée, un sel tiocial sera également obtenu.
Structure
Liens
 Structures de résonance tiocianate. Source: Ben Mills via Wikipedia.
Structures de résonance tiocianate. Source: Ben Mills via Wikipedia. L'image supérieure montre comment la charge négative du SCN est distribuée-. Notez que tous les atomes ont une hybridation SP2, Alors ils sont situés dans la même ligne.
La paire d'électrons peut être bien située sur l'atome d'azote ou sur l'atome de soufre. Ce fait explique une caractéristique importante du tiocianate: c'est un ligand bident, c'est-à-dire capable de lier de deux manières différentes.
Isomère
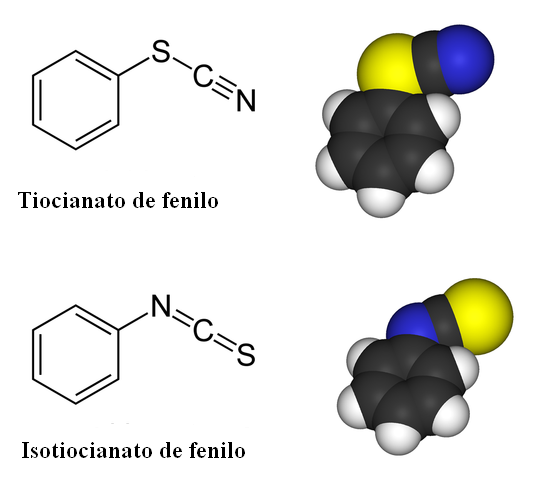
 Isoméria de liaison pour le tiocyanate phényle. Source: Benjah-Bmm27 / Domaine public
Isoméria de liaison pour le tiocyanate phényle. Source: Benjah-Bmm27 / Domaine public Dans les composés tiociaux, l'isomère de liaison est présent. Comme on peut le voir dans l'image supérieure, le SCN- Il peut être lié à un anneau benzénique ou à un groupe phényle, soit par son atome de soufre ou l'atome d'azote. Lorsqu'il est lié au S, il est appelé tiocianate; Alors que lorsqu'il est lié au N, il s'appelle isotiocial.
Peut vous servir: Stanislao CannizzaroNotez comment -SCN ou -NCS ressemblent à des fragments linéaires. Cette géométrie linéaire reste inchangée à la fois dans les tiocians organiques et inorganiques.
La liaison -cs est plus forte que -SCN, car l'azote, car il est plus petit, concentre mieux la charge négative de la paire d'électrons avec laquelle la liaison covalente se formera.
Interactions
Anions SCN- Ils ne peuvent pas interagir les uns avec les autres à cause des répulsions électrostatiques. Par conséquent, ils ont besoin de cations afin qu'ils puissent interagir électrostatiquement et ainsi "construire" un cristal. Les tiocians inorganiques sont des composés en essence ionique.
Pendant ce temps, pour les tiociateurs organiques, leurs interactions sont basées sur les forces de van der Waals; surtout, ceux d'un type dipolo dipolo. Le groupe SCN, soit lié, est polaire et contribue donc à une augmentation de la polarité du composé. De toute évidence, les interactions dipol-dipolo sont plus faibles que les attractions ioniques, présentes par exemple au KSCN+SCN-).
Tiociation organique
Les tiociateurs organiques sont représentés avec la formule RSCN. D'un autre côté, ayant une isoméria de liaison, nous avons également les isoocians, les RNC.
Ainsi, il suffit de remplacer R par des fragments moléculaires alkyle ou aromatiques pour obtenir plusieurs composés. Par exemple, Cho3Ch2SCN est l'éthyle tiocianate. Dans la section précédente R6H5SCN ou φ-SCN.
Tiociations inorganiques
Les tiocyanates inorganiques sont considérés comme des sels d'acide tiocianique, HSCN, et peuvent être représentés comme MSCN, où m est un cation métallique ou un cation ammonium. Ainsi, nous avons par exemple:
-NASCN, tiocyanate de sodium
-NH4SCN, Ammonium Tiocianate
Il peut vous servir: différences entre les composés organiques et inorganiques-Foi (SCN)3, Tiocyanate ferrique
De nombreux tiocians inorganiques sont des sels solides incolores.
D'un autre côté, nous avons également les complexes tiociaux en solution. Par exemple, une solution aqueuse qui contient des ions foi3+ sera complété avec des ions SCN- Former [foi (ncs) (h2SOIT)5]]2+, qui est rouge sang.
De même, le SCN- Il est capable de complexer avec d'autres cations métalliques, comme le CO2+, Cu2+ et toi4+, Chacun originaire d'un complexe coloré.
Applications
L'anion SCN- Il est utilisé pour les déterminations de métaux photométriques dans des solutions aqueuses. Cette méthode est basée précisément sur la mesure de l'absorbance des complexes colorés des tiocians avec des métaux.
De cette utilisation spécifique, d'autres sont aussi variées que les tiocians qui existent.
Les tiocians organiques sont destinés plus que tout comme blocs structurels pour la synthèse des composés de soufre utilisés en médecine.
D'un autre côté, les tiocians inorganiques qui ont des colorations sont utilisés pour l'industrie du textile ou comme additifs pour les peintures en bateau. Aussi, car ce sont de bons donateurs SCN ION-, Ils sont nécessaires pour la production d'insecticides et de fongicides.
Parmi les Tiociateurs, les plus populaires sont les NASCN et KSCN, tous deux très demandés dans les industries des médicaments, des constructions, des électroniques et agrochimiques.
Les références
- Morrison, R. T. Et Boyd, R, n. (1987). Chimie organique. 5e édition. Éditorial Addison-Wesley Inter-American.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. (10e édition.). Wiley Plus.
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2020). Thiocyanate. Récupéré de: dans.Wikipédia.org
- Centre national d'information sur la biotechnologie. (2020). Thiocyanate. Base de données PubChem., CID = 9322. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Elsevier B.V. (2020). Thiocyanate. ScienceDirect. Récupéré de: ScienceDirect.com
- Nouryon. (2020). Thiocyanate. Récupéré de: Sulfurderivatives.Nouryon.com
- Riedel, k., Hagundan, h.W. Et Scherer, G. (2013). Thiocyanate dans le plasma et la salive [méthodes de biomonitoring, 2013]. Dans The Mak - Collection for Occupational Health and Safety (Eds and). Doi: 10.1002/3527600418.BI5712SALE0013
- « Caractéristiques des textes journalistiques, structure, types, exemples
- Caractéristiques spécialisées de textes, structure, types, exemples »

