Bases acides Arrhenius, Bronsted-Lowry Theories, Lewis

- 1101
- 124
- Noa Da silva
 Graphique qui relie les trois principales théories des acides et des bases. Source: TEM5PSU, CC BY-SA 3.0, via Wikimedia Commons
Graphique qui relie les trois principales théories des acides et des bases. Source: TEM5PSU, CC BY-SA 3.0, via Wikimedia Commons Quelles sont les théories acides et de base?
Les théories acides et de base sont un ensemble de contributions conceptuelles qui définissent et différencient les acides et les bases, deux conglomérats d'immenses substances de pertinence dans les domaines de la chimie.
Ses racines proviennent des premières caractérisations faites par Robert Boyle en 1661, qui définissaient des acides tels que des substances aigres et corrosives qui changent la couleur du papier bleu en printemps rouge; Et les bases telles que les substances savonneuses qui, contrairement aux acides, changent la couleur du papier rouge en rouge bleu.
Antoine Lavoisier a proposé que tous les acides contiennent des atomes d'oxygène, tels que H2Swin4 et HNO3. Des siècles plus tard en 1811, Humphry Davy a constaté que de nombreux acides ne possédaient en fait pas d'atomes d'oxygène, tels que HCl, HF, HBR, etc.
Et peu de temps avant l'apparition de la célèbre triade acide-base (image supérieure), Justig Liebig a suggéré que les acides ont des atomes d'hydrogène qui peuvent être remplacés par des cations métalliques.
Cette connaissance empirique a servi d'inspiration aux théories actuelles des acides et des bases: Arrhenius, Bronsted-Lowry et Lewis. Comme le montre le graphique, la théorie d'Arrhenius est la plus restrictive ou la plus limitée de toutes, tandis que celle de Lewis est la plus générale et la plus mondialisée.
Théorie d'Arrhenius
Proposé par le 1884 par Svante Arrhenius, sa théorie dit que les acides lorsqu'ils sont dissous dans l'eau produisent des ions h3SOIT+ ou h+; Pendant les bases, lors de la dissolution dans l'eau, produisez ou libérez les ions OH-.
Les ions h3SOIT+ et oh- Ils se combinent dans une réaction réversible qui donne naissance à des molécules d'eau:
H3SOIT+ + Oh- ⇌ 2h2SOIT
Peut vous servir: acide disulfurique: qu'est-ce que la structure, les propriétés, les utilisationsAinsi, un acide Arrhenius est aussi celui qui augmente la concentration des ions H3SOIT+, Tandis qu'une base d'Arrhenius est celle qui augmente la concentration d'ions oh-.
Cela signifie qu'un acide Arrhenius ne devrait pas nécessairement contenir des ions H3SOIT+, Et une base d'Arrhenius n'a pas besoin d'avoir des ions oh- Dans sa structure.
Exemple et limitations
Considérez les dissociations suivantes:
HCl (AC) → H+(AC) + CL-(AC)
NaOH (AC) → Na+(Ac) + oh-(AC)
HCl est un acide Arrhenius car lorsqu'il est dissous dans l'eau, il produit des ions H+, ou plus correctement, les ions h3SOIT+. Et d'un autre côté, Naoh est une base d'Arrhenius parce que lorsqu'elle est dissoute dans l'eau, les ions OH sont sortis-. Ces substances réagissent les unes aux autres pour produire du sel et de l'eau:
HCl (AC) + NaOH (AC) → NaCl (AC) + H2SOIT
Le problème avec la théorie d'Arrhenius réside dans le fait qu'il n'est limité qu'aux solutions aqueuses et ne s'applique donc que pour les substances solubles dans l'eau. Par exemple, le MGO est très insoluble dans l'eau, et pourtant c'est un oxyde de base.
Il est également incapable d'expliquer par lui-même comment des substances telles que NH3 Et Cao produit des ions oh- dissous dans l'eau, même lorsqu'ils n'ont pas d'ions oh- Dans sa structure moléculaire ou cristalline (comme c'est le cas de NaOH ou KOH).
Et il n'explique pas comment le CO2 peut libérer les ions h3SOIT+ Dans l'eau sans avoir d'atome d'hydrogène dans sa structure moléculaire (comme c'est le cas avec HCl ou H2Swin4).
Théorie de la laine de brönsted
Proposition individuellement en 1923 par Johannes Bronsted et Thomas Lewry, leur théorie des acides et des bases dit qu'un acide est toute cette substance qui peut donner des ions H+, et qu'une base est plutôt toute substance capable d'accepter ces H+. Cette théorie est plus générale que celle d'Arrhenius et couvre plusieurs de ses limites.
Peut vous servir: solutions molaires: concept, préparation, exemplesExemple
Considérez à nouveau l'équation de neutralisation entre H3SOIT+ et un oh- Pour produire deux molécules d'eau:
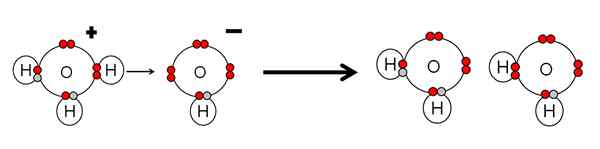 Exemple de neutralisation acide et de base d'eau. Source: Gabriel Bolívar.
Exemple de neutralisation acide et de base d'eau. Source: Gabriel Bolívar. Notez que H3SOIT+ Fait un h+ qui sera immédiatement lié ou coordonné avec l'OH- à droite. Quand h+ Il se termine lié à l'une des paires sans électrons du OH-, Deux molécules d'eau neutres restent en tant que produits.
Le H3SOIT+ C'est donc un acide de lowry brnsted, pour donner le H+, Et le oh- C'est une base brnsted-lowry pour accepter ce h+.
Un autre exemple de réaction acide-base est le suivant:
NH3(g) + HCl (g) → NH4CL (S)
Cette réaction, selon Arrhenius, ne pouvait pas être considérée. Le NH3 C'est une base brnsted car elle accepte le HCl H en donnant quelques électrons situés sur l'atome d'azote; Et le HCl, logique, devient l'acide brnsted.
Ainsi, le MGO est une base brnsted car elle est capable d'accepter H+ d'acides pour se transformer en mg (OH)2.
Théorie de Lewis
La théorie de Bronsted-Lowry explique un large éventail de réactions acides-base. Cependant, ignorez ces réactions où+ et oh- Ils ne sont pas du tout impliqués, ainsi qu'une plus grande participation des électrons libres dans les mécanismes moléculaires.
Ainsi, en 1923 g. N. Lewis a proposé une théorie acide-base qui dit ce qui suit: Un acide est toute substance capable d'accepter des paires d'électrons, tandis qu'une base est celle qui donne ces paires d'électrons.
Il peut vous servir: DAPI (4 ', 6-Diamidino-2-Fenylindol): caractéristiques, fondation, utilisationPar exemple, ion h+ C'est un acide Lewis car il accepte des paires d'électrons de toutes les espèces autour: de H2Ou pour créer H3SOIT+, de NH3 Pour originaire de NH4+, etc.
Exemple et avantages
Considérez un autre exemple dans la réaction suivante:
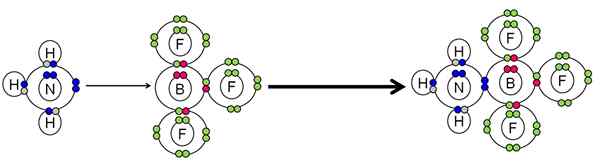 Exemple de neutralisation entre un acide et une base de Lewis. Source: Gabriel Bolívar.
Exemple de neutralisation entre un acide et une base de Lewis. Source: Gabriel Bolívar. Le NH3 Fait une paire d'électrons (bleu) de l'atome d'azote à l'atome de bore BF3. Par conséquent, le NH3 C'est la base de Lewis car donne la paire d'électrons et le BF3 C'est l'acide de Lewis parce qu'il les accepte.
En général, les cations et les espèces d'électrons pauvres sont des acides Lewis, tandis que les anions et les espèces riches en électrons sont des bases Lewis.
Les avantages offerts.
Par exemple: H2O il a des électrons libres dans l'oxygène. Si vous donnez l'un d'eux à un ion h+, agira comme une base de Lewis, étant le H+ Par conséquent Lewis Acid.
Selon Bronsted-Lowry, H2Ou j'agirais comme une base car il accepte précisément h+ En donnant quelques-uns de leurs électrons libres. Et enfin, h2Ou c'est aussi une base selon la théorie d'Arrhenius parce que la concentration des ions Hin+ dans l'environnement aqueux, et par conséquent augmenter la concentration des ions OH-.
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Clark Jim. (2002). Théories des acides et des bases. Récupéré de: Chemguide.co.ROYAUME-UNI
- Broderick C., Moussa m., & Clark J. (21 août 2020). Aperçu des acides et des bases. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- Wikipédia. (2020). Réaction acide-base. Récupéré de: dans.Wikipédia.org
- Texas A&M University. (s.F.). Acides et bases: développement d'acides et de bases. Récupéré de: Chem.tamu.Édu

