Lien de pont hydrogène
- 3614
- 569
- Paul Dumas
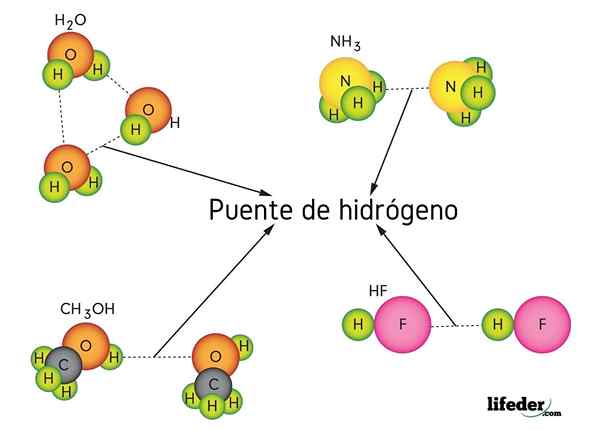
 Pont hydrogène dans l'eau (h2O), méthanol (cho3OH), le fluorure d'hydrogène (HF) et l'ammoniac (NH3)
Pont hydrogène dans l'eau (h2O), méthanol (cho3OH), le fluorure d'hydrogène (HF) et l'ammoniac (NH3) Qu'est-ce qu'une liaison de pont hydrogène?
La liaison du pont hydrogène est un type spécial d'interaction dipol-dipolo, appartenant aux forces de van der Waals, dans lesquelles un atome d'hydrogène rejoint deux ou plusieurs molécules sans être liée de manière covalente. On ne parle pas d'un compartiment électronique, mais d'un phénomène principalement électrostatique.
Comme son nom l'indique, l'hydrogène agit comme un pont, il doit donc être entre deux atomes. L'hydrogène est lié (H-X) à un atome très électronégatif (comme N, O et F), et aborde un autre atome électronégatif mais d'une molécule voisine. Il en résulte la formation du pont hydrogène x ··· H-x.
Notez que dans la représentation X ··· H-X, les points symbolisent le pont hydrogène, tandis que le script représente la liaison covalente entre H et X. Cela dit, regardons le pont hydrogène entre deux molécules d'eau, où x est l'atome d'oxygène: H2Ou ··· H-oh (image inférieure).
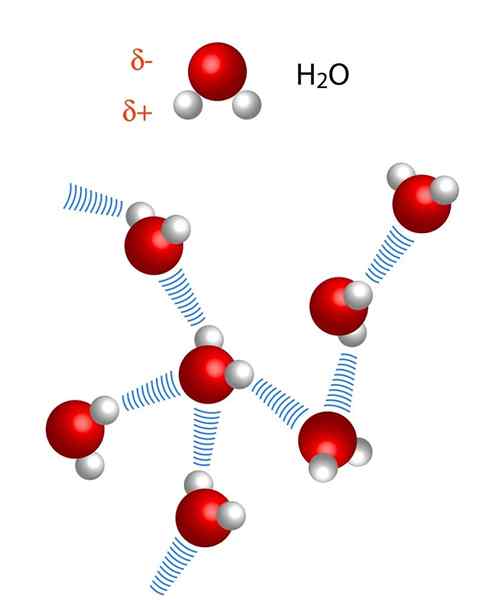
Dans l'image ci-dessus, nous voyons que sept molécules d'eau restent ensemble grâce à leurs ponts d'hydrogène, représentés par des lignes bleues. Un pont hydrogène seul n'est pas très fort, mais quand il y en a des milliards, ils donnent des propriétés anormales et inattendues.
Caractéristiques du pont hydrogène
Compositionnel
Le pont hydrogène doit vraiment être représenté comme x '··· H-X, où x est ce qui est connu comme le donneur de pont hydrogène, car il est lié de manière covalente à l'hydrogène (il le donne).
Pendant ce temps, X 'est l'accepteur du pont hydrogène, présent dans une molécule voisine (le reçoit). Ainsi, nous avons un atome de donneur (X), un hydrogène (H) et un atome accepteur (x ') composant le pont hydrogène (x' ··· h-x).
Géométrique
Quand nous pensons à un pont, des surfaces plates ou cambrées viennent à l'esprit. Parce qu'il est supposé que les liens ne courbent pas, nous aurons alors deux distances: X ··· H et H-X, qui composent le pont hydrogène x ··· H-X.
Peut vous servir: réaction irréversible: caractéristiques et exemplesEntre ces deux distances, il y a un angle, qui est souvent 180 °; C'est-à-dire que les trois atomes de notre pont reposent sur la même ligne horizontale (ou verticale).
Lorsque l'angle est différent de 180 °, le pont X ··· H-X n'est plus droit ni linéaire, mais acquiert d'autres géométries.
D'un autre côté, les distances dans les ponts d'hydrogène ne sont pas identiques. La distance H-X est plus courte que X ··· H, qui peut être vue à l'image des molécules d'eau. Ainsi, par exemple, la distance H-X est généralement à 110 pm (1 · 10-12m), tandis que l'autre distance x ··· h est à 160 pm.
Associatif
Une caractéristique particulière du pont hydrogène est qu'elle permet aux molécules d'être beaucoup plus associées les unes aux autres. Ils ne marchent pas de côté à un autre s'ignorant. Par conséquent, il établit un ordre momentané dans les seins des liquides; Et dans le cas des solides, ils contribuent à la définition de leurs cristaux.
Où nous voyons un pont hydrogène, nous pouvons penser à l'association et, par conséquent, dans un certain ordre (bien que dynamique et changeant) en échelles moléculaires.
Énergie
Briser un pont d'hydrogène n'est pas très difficile. Les molécules d'eau, par exemple, marchent et créant à chaque fois tout en se mobilisant. Mais en casser beaucoup d'entre eux en même temps impliquerait de désordonner un nombre infini de molécules. Nous parlons de fournir une telle énergie qui brise les moles de ces ponts d'hydrogène (6.02 · 1023 X ··· H-x).
Ainsi, la force du pont hydrogène varie en fonction de l'identité et de la nature des molécules. Par exemple, la force du pont hydrogène ou de ··· H-O entre l'eau et l'alcool est de 5 kcal / mol: 5 kcal d'énergie est nécessaire pour briser une taupe de ce pont hydrogène en question.
Peut vous servir: changements chimiques: caractéristiques, exemples, typesExemples de ponts d'hydrogène
Eau
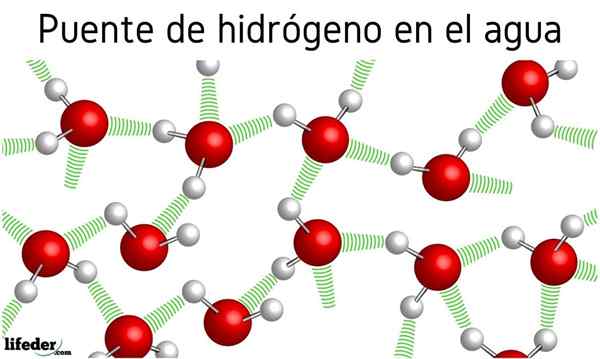
Au début, on a parlé de ponts d'hydrogène entre les molécules d'eau, mais l'effet qu'il a sur leurs propriétés n'a pas été mentionné. Grâce à eux, l'eau bouille à 100 ° C, laissant les points d'ébullition des molécules apparentées comme H2S, qui bout à -60 ºC; ou h2Je sais, faire bouillir à -41.25 ºC.
Cette différence épouvantable est due aux ponts d'hydrogène de l'eau, qui définissent également d'autres de leurs propriétés anormales, telles que leur énorme chaleur spécifique, les cristaux de glace, leur constante diélectrique, etc.
Éthanol
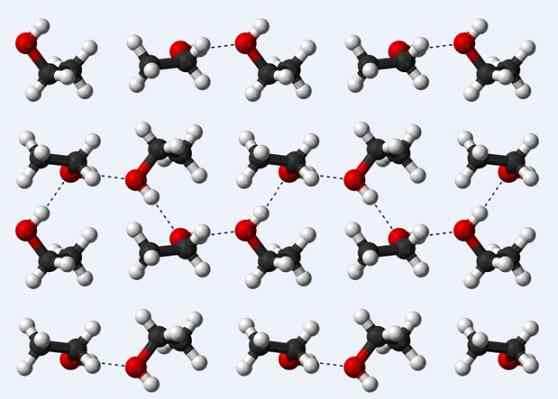 Ponts d'hydrogène dans un cristal d'éthanol
Ponts d'hydrogène dans un cristal d'éthanol Voyons maintenant un autre pont hydrogène: celui entre les molécules d'éthanol, ch3Ch2Oh (ci-dessus). Notez comment les molécules sont hébergées3Ch2Oh de telle manière que leurs ponts d'hydrogène sont établis3Ch2Ho ··· hoch2Ch3 (pointillés).
Cependant, les molécules sont trop ordonnées de supposer que nous parlons d'éthanol liquide, mais constituent plutôt un verre (éthanol solide).
Le pont hydrogène décrit pour l'éthanol est similaire à celui des autres alcools, avec la différence que leurs squelettes gazéifiés peuvent entraver l'efficacité desdits ponts.
Acide acétique
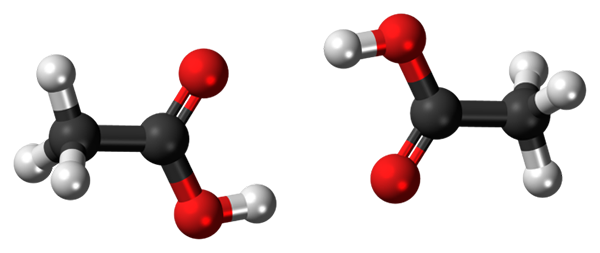 Ponts à hydrogène entre deux molécules d'acide acétique. Source: Jynto, CC0, via Wikimedia Commons
Ponts à hydrogène entre deux molécules d'acide acétique. Source: Jynto, CC0, via Wikimedia Commons Acide acétique, CHO3COOH, est capable d'établir deux ponts d'hydrogène qui unissent deux molécules en même temps. Parce qu'ils sont deux molécules liées par les ponts d'hydrogène, nous parlons d'un dimère.
Notez que l'un de ces ponts hydrogène est C = O ··· H-O et l'autre O-H ··· O = C. L'acide acétique présente la particularité que dans la phase de vapeur, il existe comme ce dimère.
Il peut vous servir: acide manganique ou permanganiqueCellulose
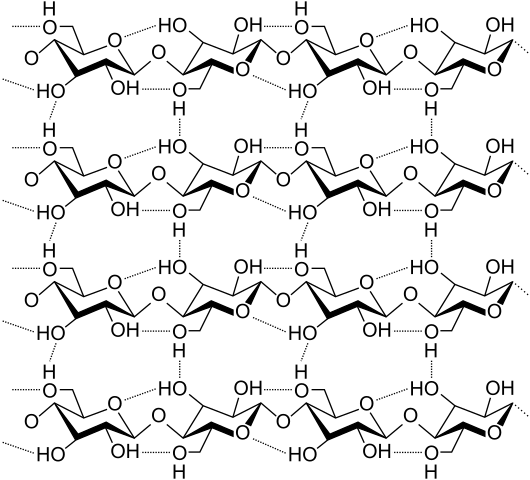 Ponts d'hydrogène entre plusieurs chaînes de cellulose. Source: Laghi.L, CC BY-SA 3.0, via Wikimedia Commons
Ponts d'hydrogène entre plusieurs chaînes de cellulose. Source: Laghi.L, CC BY-SA 3.0, via Wikimedia Commons Voyons maintenant des ponts d'hydrogène plus diversifiés et multiples. La cellulose, un polymère naturel, se compose de chaînes composées de plusieurs unités de β-glucose.
Chaque chaîne reste fixée à une autre grâce à de nombreux ponts d'hydrogène (image supérieure), qui renforcent la cohésion entre les chaînes.
ADN
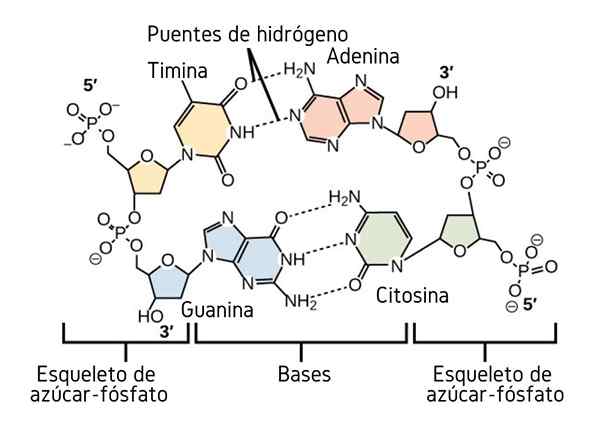 Ponts d'hydrogène entre les bases d'azote de l'ADN. Source: CNX OpenStax, CC par 4.0, via Wikimedia Commons
Ponts d'hydrogène entre les bases d'azote de l'ADN. Source: CNX OpenStax, CC par 4.0, via Wikimedia Commons Jusqu'à présent, nous avons vu l'effet associatif des ponts d'hydrogène pour imposer l'ordre entre les molécules. Mais qu'en est-il d'une macromolécule? Dans une macromolécule, comme l'ADN, nous trouvons des ponts d'hydrogène internes ou intramoléculaires entre sa base de thymine, d'adénine, de guanine et de cytosine (ci-dessus) (ci-dessus).
Les ponts d'hydrogène intramoléculaire entre ces paires de bases azotés, font acquérir la molécule d'ADN une structure à double hélice, qui est idéale pour sa réplication. Si ces ponts d'hydrogène sont cassés par chauffage, la double hélice finira par s'ouvrir en deux segments ou bandes individuelles.
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Edward E. Ávila & Asilé J. Mûre. (2004). Le pont hydrogène et ses applications sont liés. Université de Los Andes, Faculté des sciences, Département de chimie.
- Wikipédia. (2020). Liaison hydrogène. Récupéré de: dans.Wikipédia.org
- Pietri J. & Clark J. (21 août 2020). Liaison hydrogène. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- Les éditeurs d'Enyclopaedia Britannica. (2020). Liaison hydrogène. Récupéré de: Britannica.com
- Helmestine, Anne Marie, Ph.D. (29 octobre 2020). Quels sont l'exemple de liaison hydrogène? Récupéré de: Thoughtco.com

