Structure Technecio (TC), propriétés, utilisations, obtention
- 1343
- 189
- Mlle Ambre Dumont
Il Técnecio (TC) est un élément chimique du groupe VII du tableau périodique. Votre numéro atomique est 43. Son nom dérive du mot grec "tekhnetos", qui signifie artificiel, et a été affecté parce qu'au moment où il a été découvert, il avait été créé artificiellement. De nos jours, il est connu que c'est naturellement dans la croûte terrestre, mais seulement en petites quantités.
C'est un métal radioactif. Il a de nombreux isotopes, qui sont des atomes de technium avec différentes quantités de neutrons dans le noyau. Ils occupent le même endroit dans le tableau périodique mais ils ont des masses atomiques différentes.
 Symbole de numéro atomique et masse atomique de l'élément Tecnecio. ME / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 2.5). Source: Wikimedia Commons.
Symbole de numéro atomique et masse atomique de l'élément Tecnecio. ME / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 2.5). Source: Wikimedia Commons. Tous ses isotopes ont une courte durée de vie par rapport à celle de la terre, donc le technium généré lorsque la planète a été formée a diminué presque tout depuis longtemps.
Le plus important des isotopes est le Tecnécio-99m, qui est largement utilisé en médecine nucléaire pour le diagnostic de diverses maladies.
Tecnecio est produit dans les réacteurs nucléaires. Sa présence en matière stellaire a également été détectée.
[TOC]
Structure
Sa configuration électronique est:
1s2 2s2 2p6 3s2 3p6 3ddix 4s2 4p6 4d5 5s2,
ou aussi:
[Kr] 4d5 5s2.
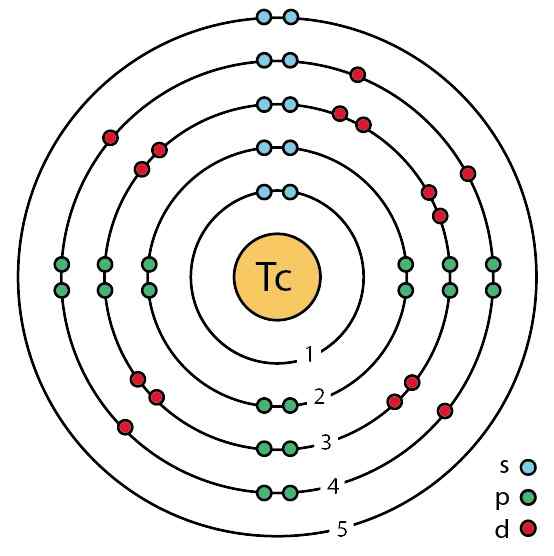
Vous trouverez ci-dessous un modèle bohr de l'atome de técnecio où différentes orbitales peuvent être vues avec leurs électrons autour du noyau.
 Électrons dans les orbitales de l'atome de Tecnecio. Ahazard.ScienceWriter / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 4.0). Source: Wikimedia Commons.
Électrons dans les orbitales de l'atome de Tecnecio. Ahazard.ScienceWriter / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 4.0). Source: Wikimedia Commons. Cristallise dans un arrangement ou un réseau hexagonal compact.
Nomenclature
- Tecnecio, symbole: TC
- 99TCM, 99mTC, Tecnecio-99m: Diverses façons d'indiquer l'isotope Metero-metestable du technium avec masse atomique 99
- Tecnecio-95m: isotope métaestable avec masse atomique 95
Propriétés
État physique
Solide métallique avec une luminosité en argent.
 Feuille d'or recouverte de tecnecio. L'ampoule qui le contient est scellé et est plein de gaz argon inerte. Marco Cardin / CC By-S (https: // CreativeCommons.Org / licences / by-sa / 4.0). Source: Wikimedia Commons.
Feuille d'or recouverte de tecnecio. L'ampoule qui le contient est scellé et est plein de gaz argon inerte. Marco Cardin / CC By-S (https: // CreativeCommons.Org / licences / by-sa / 4.0). Source: Wikimedia Commons. Masse atomique standard
98
Point de fusion
2157 ºC
Point d'ébullition
4262 ºC
Densité
11 g / cm3
Solubilité
Il se dissout dans l'acide nitrique (HNO3), Dans Regia agua (qui est un mélange de HNO3 concentré concentré) et de l'acide sulfurique concentré (h2Swin4). Il est insoluble dans l'acide chlorhydrique (HCL) ou le fluorhorique (HF).
Propriétés chimiques
Les états d'oxydation adoptés par cet élément sont +4, +5 et +7. Tecnecio perd lentement sa luminosité métallique lorsqu'elle est exposée à l'air humide, alors qu'un oxoacide se produit.
Peut vous servir: lien ionique: caractéristiques, comment elle est formée et des exemplesIl brûle de l'oxygène au-dessus de 400 ° C pour donner l'oxyde TC2SOIT7 qui sublima (passe du solide au gaz directement). Ne réagit pas avec le peroxyde d'hydrogène (h2SOIT2).
Isotopes
Tecnecio a 22 isotopes. Les isotopes sont des atomes du même élément qui ont des quantités différentes de neutrons dans le noyau, donc ils ont des masses différentes. Tous sont radioactifs, donc instables et ont des masses atomiques entre 90 et 111.
Les isotopes avec une vie moyenne plus longue sont: 97TC dont la demi-vie est 4,2 × 106 années, 98TC avec une demi-vie de 6,6 × 106 années et 992,1 × 10 TC5 années. La demi-vie est le temps moyen qu'il faut pour que l'isotope radioactif se désintégre.
 Cloche de laboratoire spécialement conçue avec du verre et du mur de plomb pour gérer Tecnecio, dont les isotopes sont tous radioactifs. Jejecam / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 3.0). Source: Wikimedia Commons.
Cloche de laboratoire spécialement conçue avec du verre et du mur de plomb pour gérer Tecnecio, dont les isotopes sont tous radioactifs. Jejecam / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 3.0). Source: Wikimedia Commons. Comportement biochimique
Bien que cet élément n'ait pas de fonction biochimique dans les êtres vivants, il a la capacité de rejoindre chimiquement de nombreuses molécules biologiquement actives.
Obtention
Découverte
C'était le premier élément produit artificiellement. Son existence avait été prédite par le chimiste russe Dmitri Mendeléyev au XIXe siècle, qui a attribué sa place actuelle dans le tableau périodique.
Ce n'est qu'en 1937 qu'il a été découvert dans un échantillon de molybdène qui avait été bombardé de neutrons dans un laboratoire physique à Berkeley. À partir de ce moment, il a commencé à chercher des matériaux terrestres.
Peu de présence naturelle
En 1962, il a été retrouvé en Afrique dans un minéral naturel à Uraninita, comme produit de la fission spontanée de l'uranium-238. Sa concentration dans ce type de roche est extrêmement petite.
Sa présence dans certains types d'étoiles a été détectée, ce qui a conduit à de nouvelles théories sur la production d'éléments lourds dans la matière stellaire.
Production
Il se forme artificiellement dans les réacteurs nucléaires à partir de la fission d'uranium. Il est extrait des tiges de combustible nucléaire dépensées, sous la forme d'une poudre grise.
Pour chaque tonne d'uranium, un milligram tecnecio est généré. Il y a actuellement de très grandes quantités (tonnes) qui se sont accumulées au fil des ans.
Peut vous servir: Mercury fulminate: structure, propriétés, obtention, utilisations Obtention de Tecnecio-99m dans un laboratoire en 1958. Laboratoire national de Brookhaven. / Domaine public. Source: Wikimedia Commons.
Obtention de Tecnecio-99m dans un laboratoire en 1958. Laboratoire national de Brookhaven. / Domaine public. Source: Wikimedia Commons. Applications
- Dans le domaine de la médecine nucléaire
Tecnecio-99m (où "m" signifie métastable) est l'isotope qui est la plus utilisée. Il a une demi-vie de 6,01 heures. Il est largement utilisé pour les études diagnostiques médicales car elle émet des rayons gamma.
L'utilisation de leurs combinaisons avec d'autres substances chimiques est injectée à des patients qui seront évalués. Une fois introduit dans l'organisme, il est absorbé par certains organes et les rayons gamma qu'il émet permettent d'obtenir des images de différentes parties du corps.
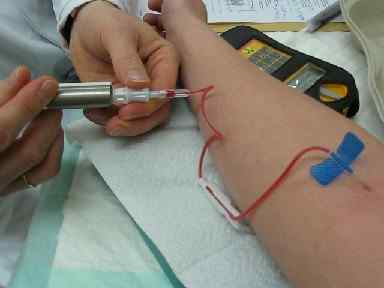 Injection de composés Tecnecio-99m pour effectuer des tomographies en médecine nucléaire. Bionerd / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 3.0). Source: Wikimedia Commons.
Injection de composés Tecnecio-99m pour effectuer des tomographies en médecine nucléaire. Bionerd / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 3.0). Source: Wikimedia Commons. Coeur
Lorsque le técnecio-99m rejoint le pyrophosphate, il a la capacité d'adhérer aux dépôts de calcium des muscles détériorés du cœur qui permet d'évaluer les lésions causées par une crise cardiaque.
Artères et veines
S'il est combiné avec un composé d'étain, il rejoint les globules rouges et sert à faire une carte des troubles du système circulatoire.
Rate
Avec le soufre s'accumule dans la rate et une image claire de cet organe peut être obtenu.
Vous trouverez ci-dessous un exemple du type d'images obtenues grâce aux rayons gamma émis par Tecnecio-99m:
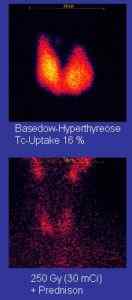 Gammographie Images de la région du cou où la thyroïde peut être vue. Ils sont obtenus avec TC-99M. MBQ / Utilisation gratuite protégé par le droit d'auteur. Source: Wikimedia Commons.
Gammographie Images de la région du cou où la thyroïde peut être vue. Ils sont obtenus avec TC-99M. MBQ / Utilisation gratuite protégé par le droit d'auteur. Source: Wikimedia Commons. Os
TC-99M est utilisé pour évaluer le degré d'activité des ostéoblastes dans une lésion osseuse. Les ostéoblastes sont des cellules osseuses qui génèrent une matrice osseuse.
Le balayage ou les explorations avec cet isotope sont très sensibles et permettent de détecter les métastases (propagation des cellules cancéreuses) et les lymphomes dans les os (prolifération maligne des lymphocytes dans la moelle osseuse).
Cerveau
Le dimère éthylcitéiné de 99mTC est facilement absorbé par les tissus du cerveau, qui vous permet d'obtenir des images de cet organe au moyen de la tomographie par émission monofotonique informatisée.
- Autres utilisations
Sous forme d'ions pertestnetate (TCO4-) agit comme un inhibiteur de la corrosion pour l'acier, étant encore en très petites quantités. Cependant, il doit être utilisé dans les systèmes fermés en raison de la radioactivité de Tecnecio.
Il peut vous servir: Hydroxyde de nickel (iii): structure, propriétés, utilisations, risquesÀ la température de 11 K (-262,15 ° C) ou plus bas, il se comporte comme un supraconducteur exceptionnel.
Le técnecio-95m est un isotope qui a une demi-vie de 61 jours et est utilisé comme marqueur ou traceur radioactif en écologie, par exemple pour tracer les composés polluants et étudier le mouvement des eaux de surface.
- Applications potentielles
Il s'agit d'un catalyseur plus efficace que le Renio (Re) ou le Paladium (PD) dans la réaction de la déshydrogénation de l'alcool isopropylique. Son utilisation dans les batteries nucléaires a également été proposée.
Mais sa radioactivité est un problème pour ces utilisations.
Des risques
Santé
Il est radioactif, donc très nocif pour la santé des êtres vivants. On estime que l'exposition humaine à cet élément est principalement due à l'utilisation de 99TCM en médecine nucléaire.
 Symbole qui indique un danger de rayonnement. Auteur: Catalan Catalino. Source: Pixabay.
Symbole qui indique un danger de rayonnement. Auteur: Catalan Catalino. Source: Pixabay. Dans de tels cas, cet isotope, après un certain temps, est déposé principalement dans la glande thyroïde et dans le tractus gastro-intestinal, mais selon certaines études, elle est éliminée par l'urine dans quelques jours.
Atmosphère
Parce que les réacteurs nucléaires le produisent en grande quantité, Tecnecio est une charge supplémentaire qui se lie aux déchets radioactifs indésirables sur la planète.
Les références
- Société royale de chimie. (2020). Technétium. RSC a récupéré.org.
- Lentech b.V. (2020). Technétium - TC. Récupéré de Lentech.com.
- Andersen, ou. (2016). Décorporation des radionucléides. Technétium. En thérapie par chélation dans le traitement de l'empoisonnement métallique. Récupéré de ScienceDirect.com.
- Lor Randall, R. (2010). Approche du diagnostic des tumeurs osseuses et des tissus mous - aspects cliniques, radiologiques et classification. En os et pathologie des tissus mous. Récupéré de ScienceDirect.com.
- Infeld, b. Et Davis, S.M. (2004). Tomographie par calcul des images à thoton unique. 99mTC-ECD SPECT. En AVC (quatrième édition). Récupéré de ScienceDirect.com.
- Coton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley & Sons.
- Diriger, D.R. (éditeur) (2003). CRC Handbook of Chemistry and Physics. 85e CRC Press.
- « Quelle est la relation entre la chimie et la médecine?
- Caractéristiques et exemples de la recherche sur la recherche »

