Svante August Arhenius Biographie, théories, contributions, œuvres
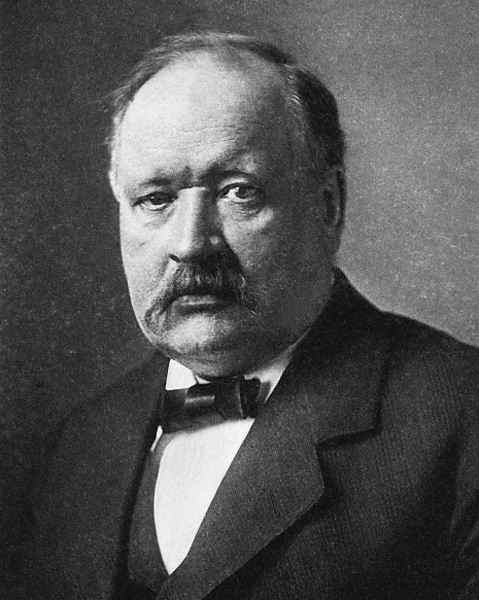
- 4663
- 1342
- Paul Dumas
Svante August Arhenius (1859-1927) Il était un physique suédois et un chimiste connu pour son travail dans le domaine de la dissociation électrolytique et d'autres théories qui ont fait de lui une référence mondiale pour la recherche scientifique.
Il a été le premier Suédois à recevoir le prix Nobel de chimie, écrivain de textes scientifiques et reconnu comme le père de la physique; Il a exercé un enseignement universitaire et publié des hypothèses sur l'origine de la vie et la formation des étoiles et des comètes.
 Domaine de pub da vor dem 1. Jan. 1923 Veröffentlicht
Domaine de pub da vor dem 1. Jan. 1923 Veröffentlicht Les experts affirment que les expériences d'Arrhenius ont avancé dans le temps. Un exemple de cela était sa recherche sur les agents provoquant le réchauffement climatique de la planète et ses recommandations pour éviter ce problème grave qui affecte actuellement la vie sur Terre.
[TOC]
Biographie
Enfance et études
Svante August Arhenius est né le 19 février 1859 dans une ferme rustique située à Vik, en Suède,. Son père était Gustav Arhenius et sa mère Carolina Christina Thunberg.
Dès son jeune âge, il était en contact avec le monde universitaire, car son oncle Johann Arrhenius était professeur de botanique et plus tard recteur de l'École d'agriculture à Ultuna, tandis que son père travaillait comme arpenteur à l'Université d'Upsala.
Dans le but d'améliorer leur situation économique, la famille a déménagé en 1860 à Upsala, un an seulement après la naissance de Little Svante, qui s'est avéré être un prodige dès son plus jeune âge. Il est affirmé qu'à l'âge de trois ans, j'ai déjà lu et résolu des opérations mathématiques simples.
Arrhenius a étudié à l'école de la cathédrale Upsala, une enceinte de prestige historique fondée en 1246, où il a obtenu son diplôme en 1876 avec d'excellentes qualifications.
En comptant 17 ans, il est entré à l'Université d'Upsala où il a étudié les mathématiques, la physique et la chimie. Cinq ans plus tard, il a déménagé à Stockholm pour travailler sous les ordres du professeur Erick Edlund (1819-1888) à la Royal Academy of Sciences of Suède.
Initialement, Arrhenius a aidé Edlund dans les enquêtes, mais a rapidement commencé à travailler sur sa propre thèse de doctorat Recherche de conductivité galvanique sur les électrolytes, Présenté en 1884 à l'Université d'Upsala.
Cette recherche tournait autour de la dissolution des électrolytes dans des solutions aqueuses et de sa capacité à générer des ions positifs et négatifs qui ont conduit l'électricité. Malheureusement, la théorie a été décrite comme erronée, donc la recherche a été approuvée avec un score minimal et s'oppose par leurs camarades de classe.
Nouvelles expériences
Ce rejet de la communauté scientifique n'a pas arrêté Arrhenius, qui a envoyé des copies de sa thèse à des scientifiques renommés tels que Rudolf Clausius (1822-1888) Julios Lothar Meyer (1830-1895) Wilhem Ostwald (1853-1932) et Jacobus Henricus Van 'T' t 't Hoff. (1852-1811).
Peut vous servir: Lettre de la Jamaïque: arrière-plan, caractéristiques, objectifs, conséquencesArrhenius a continué à s'entraîner et à apprendre de ses collègues. Il a reçu une bourse de l'Académie des sciences qui lui a permis de voyager et de travailler dans des laboratoires de chercheurs éminents dans des endroits comme Riga, Graz, Amsterdam et Leipzig
Il a commencé son activité en tant qu'enseignant en 1891, enseignant la physique à l'Université de Stockholm. Six ans plus tard, il a été nommé recteur de cette enceinte d'enseignement supérieur.
Théories
Théorie de la dissociation électrolytique
Au cours de sa scène en tant que professeur d'université, Arrhenius a continué à travailler sur des recherches sur des solutions aqueuses traitées dans sa thèse de doctorat. Cette nouvelle revue de vos données et expériences a servi de base à présenter en 1889 sa théorie de la dissociation électrolytique.
Arrhenius a assuré qu'un électrolyte était une substance dissous dans une solution aqueuse a pu mener un courant électrique.
Après leur dissolution, ces électrolytes se sont dissociés générant une charge positive et négative à laquelle il a appelé les ions. La partie positive de ces ions a été appelée cation et anion négatif.
Il a expliqué que la conductivité d'une solution dépend de la quantité d'ions concentrés dans la solution aqueuse.
Les solutions dans lesquelles ces électrolytes ont été ionisés ont été classés comme acides ou bases, selon le type de charge négative ou positive qu'ils forment.
Ces résultats ont permis d'interpréter le comportement des acides et les bases connues jusqu'à ce moment et ont donné une explication à l'une des propriétés les plus importantes de l'eau: leur capacité à dissoudre les substances.
Cette enquête l'a fait mériter le prix Nobel de chimie en 1903, qui l'a consacré parmi ses pairs nationaux et étrangers.
Deux ans après avoir reçu cet important prix, il a assumé la direction du Nobel Institute de chimie physique nouvellement ouvert, un poste qu'il a occupé jusqu'à sa retraite en 1927.
Équation d'Arrhenius
Arrhenius a proposé en 1889 une formule mathématique pour vérifier la dépendance entre la température et la vitesse d'une réaction chimique.
Une étude similaire avait été lancée en 1884 par le scientifique Van't Hoff, mais c'est Arrhenius qui a ajouté une justification physique et l'interprétation de l'équation, offrant une approche plus pratique de cette contribution scientifique.
Un exemple de cette étude peut être observé dans la vie quotidienne, lorsque les aliments sont sauvés dans un réfrigérateur, où les basses températures permettent la réaction chimique qui fait que sa détérioration est plus lente et donc adaptée à la consommation plus longtemps.
Peut vous servir: Empire ottomanL'équation d'Arrhenius peut être appliquée aux réactions homogènes de soude, en dissolution et en processus hétérogènes.
Arhenius et le changement climatique
Il y a plus de cent ans, lorsque le réchauffement climatique n'était pas une question de débat et d'inquiétude, Arrhenius commençait déjà à l'élever en offrant des prévisions sur l'avenir de la vie sur la planète.
En 1895, il s'est consacré à l'étude du lien entre la concentration du dioxyde de carbone (CO2) Dans l'atmosphère et la formation de glaciers.
Il a conclu qu'une réduction de 50% (CO2) Cela pourrait signifier la diminution entre 4 ou 5 ° C de la température de la planète, ce qui pourrait générer un refroidissement massif, similaire aux périodes glaciaires à travers lesquelles la Terre est passée.
D'un autre côté, si ces niveaux de CO2 Un résultat inverse augmenterait 50%, une augmentation de la température entre 4 ou 5 ° C qui provoquerait un chauffage anormal, avec des conséquences dévastatrices pour le climat de la Terre.
Arrhenius a également déterminé que les combustibles fossiles et l'activité incessante de l'être humain seraient les principales causes de cette augmentation de la concentration de CO2 atmosphérique.
Leurs calculs ont prédit un effet d'incidence prouvé sur l'équilibre naturel de notre planète et qui font d'Arrhenius le premier homme à mener des enquêtes officielles sur ce sujet.
L'origine de la vie et d'autres contributions
Les sujets d'intérêt étaient très divers. Il a offert des contributions dans le domaine de la cosmologie avec une théorie sur l'origine des comètes attribuée à la pression du rayonnement solaire à sa formation; En plus d'une théorie sur l'évolution des étoiles.
L'étude sur l'origine de la vie n'a pas été négligé par ce scientifique qui, dans sa théorie de la panspermie.
Une théorie très moderne si l'on prend en compte que les scientifiques étudient actuellement la présence de matériel interplanétaire dans les météorites tombées sur Terre et la possibilité qu'ils aient servi de véhicule pour la première étincelle de vie sur la planète.
Arrhenius a reçu pendant sa vie plusieurs offres d'emploi d'autres pays, mais il a toujours préféré travailler en Suède. La période pendant laquelle il a travaillé à l'Université de Californie à États-Unis, ce qui a abouti à son livre Immunochimie (1907).
Il peut vous servir: polis grecque: caractéristiques, organisation sociale et politiquePièces
Arrhenius s'est également démarqué comme un écrivain prolifique, avec la publication d'œuvres académiques et de discours.
- Électrochimie théorique (1900).
- Traité de physique cosmique (1903).
- Théorie de la chimie, Terre et l'univers (1906).
- Immunochimie (1907).
- Mondes dans la création: l'évolution de l'univers (1908).
- Lois quantitatives en chimie biologique (1915).
- Le sort des étoiles (1915).
- Chimie et vie moderne (1915).
- Théorie des solutions (1918).
Certains textes ont été écrits exclusivement pour l'analyse approfondie de l'étude et de la pratique chimique, mais ont également fait plusieurs publications d'un récit facile à interpréter non seulement pour la communauté académique mais aussi par le grand public.
Reconnaissance
Le prix le plus important qui a été accordé à Arrhenius était incontestable.
En 1902, la Royal Society of London (Royal Society) lui a décerné la médaille Davy et cette même institution l'a nommé membre étranger en 1911.
La même année a été la première à recevoir la médaille Willard Gibbs décernée par l'American Society of Chemistry.
En 1914, il a obtenu la médaille de Faraday remise par l'Institut de physique du Royaume-Uni, en plus d'une série de distinctions et de frais offerts par une dizaine d'universités européennes distinguées.
En son honneur, ils ont également été nommés le Ram lunaire.
Vie personnelle
Les historiens affirment qu'Arrhenius était d'un grand esprit humain. En fait, pendant la Première Guerre mondiale, il a eu du mal à aider les scientifiques libres et rapatriés qui avaient été faits de prisonniers de guerre.
Il s'est marié deux fois, en 1884 avec Sofia Rudbeck, son étudiant et assistant avec qui il avait un fils. Vingt ans après son premier lien, il a épousé María Johansson, ayant trois enfants.
Il a travaillé sans relâche jusqu'à sa mort qui s'est produite à Stockholm le 2 octobre 1927 à l'âge de 68 ans.
Les références
- Bernardo Herradon. (2017). Arrhenius, l'un des parents de la chimie moderne. Tiré des Principia.Io
- Elisabeth Crawford. (2015). Svante Arrhenius, chimiste suédois. Pris de Britannica.com
- Miguel Barral. (2019). Svante Arhenius, l'homme qui a crite le changement climatique. Pris de bbvaopenmind.com
- Miguel g. Corral (2011).Les météorites pourraient faire exploser le début de la vie. Tiré d'Elmundo.est
- Svante Arrhenius. Pris de newworldyclopedia.org
- Francisco Armijo de Castro. (2012). Cent ans d'eaux minéromédicales. Deux hydrologues: Antoine Lavoisier et Svante Arrhenius. Tiré des magazines.Ucm.est

