Mécanisme de substitution électrophile aromatique et exemples

- 3963
- 1093
- Adam Mercier
La Substitution électrophile aromatique (Sear) C'est une réaction organique dans laquelle une espèce pauvre dans les électrons, c'est-à-dire une électrophie, remplace l'un des hydrogènes d'un anneau aromatique. Cette réaction s'oppose aux ajouts subis par les alcènes, démontrant l'effet de l'aromaticité sur les réactivités du benzène et de ses dérivés.
L'électrophile, plusieurs fois, est généré pendant le même mécanisme moléculaire, le produit du mélange des réactifs et un catalyseur, qui se compose d'un acide de Lewis, par exemple tous3 ou fecl3. Ces catalyseurs augmentent l'avidité de l'électrophile par les électrons de l'anneau aromatique, accélérant ainsi la réaction.
 Dans la substitution électrophile aromatique, c'est l'anneau de benzène qui attaque l'électrophile. Source: Gabriel Bolívar via Molview.
Dans la substitution électrophile aromatique, c'est l'anneau de benzène qui attaque l'électrophile. Source: Gabriel Bolívar via Molview. Dans l'image supérieure, nous avons une représentation simple de l'attaque électrophile du benzène vers l'électrophile et+. Notez que l'attaque provient des électrons de l'une de ses doubles liaisons; c'est-à-dire que ce sont les électrons du système π conjugué qui commencent la saisie.
Cette réaction permet à du benzène et à d'autres composés aromatiques d'acquérir des substituants tels que les groupes OH, pas2, Swin3H, Cl, Br, R, Cor, Coch3, entre autres. Par exemple, le phénol est synthétisé via Sear à partir du benzène et d'autres dérivés.
[TOC]
Mécanisme de substitution électrophile aromatique
Étape 1: attaque électrophylique
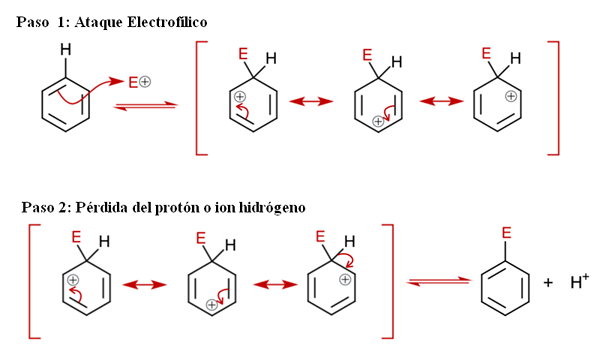 Mécanisme général pour saisir. Source: Soonlorpai via Wikipedia.
Mécanisme général pour saisir. Source: Soonlorpai via Wikipedia. Dans l'image supérieure, le mécanisme de la substitution électrophile aromatique est représenté plus en détail. L'une des trois doubles liaisons de benzène attaque l'électrophile et+, Pour former une espèce intermédiaire connue sous le nom d'Ion Arenio (Cyclohexadien délocalisé), enfermée entre parenthèses.
Peut vous servir: précipitations chimiquesNotez que la charge positive de E+ Maintenant, passez à l'intérieur de l'anneau. Mais non seulement cela: il déménage entre trois atomes de carbone dans des positions ortho (adjacentes) et pour (opposé) au carbone lié à E (c-e). Cet intermédiaire existe précisément grâce à la stabilité conférée par ses structures de résonance.
Étape 2: Perte du proton ou de l'ion hydrogène
Cependant, l'arénio ion doit bientôt neutraliser sa charge positive en perdant un proton ou un ion hydrogène. C'est là que le remplacement culmine. L'électrophile E+ remplace donc l'un des hydrogènes de benzène, laissant cela comme ion h+ en dehors du ring, de sorte que des charges positives sont préservées.
S'il est observé attentivement, toutes les étapes sont en équilibre, donc le remplacement est réversible. C'est-à-dire si les concentrations de H augmentent+, Ensuite, un hydrogène remplacera E et nous obtiendrons à nouveau les réactifs.
Exemples de substitution électrophile aromatique
Benzène
Le benzène sear est le plus simple de tous, déjà représenté ci-dessus. N'importe lequel des hydrogènes peut être remplacé par E+, Parce que tous sont chimiquement équivalents.
Il n'y a aucune différence les uns des autres. Par conséquent, la probabilité que le remplacement se produit dans l'un des six atomes de carbone est le même. Cependant, tout change lorsqu'il y a d'autres substituants présents dans l'anneau benzénique, comme nous le verrons ci-dessous.
Phénol
Ortho, pour et attaques de buts
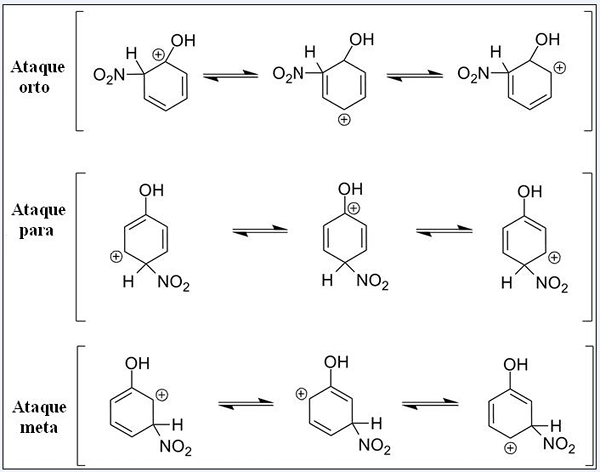 Structures de résonance du phénol dans sa réaction de substitution électrophile aromatique. Source: Pete Davis, domaine public, via Wikimedia Commons
Structures de résonance du phénol dans sa réaction de substitution électrophile aromatique. Source: Pete Davis, domaine public, via Wikimedia Commons Considérez maintenant la saisie du Fenol. Cette fois, l'électrophie est le cation nitronien, pas2+, qui, liant à l'anneau de benzène, se transforme en groupe nitro, -No2.
Peut vous servir: Nitrates: propriétés, structure, nomenclature, formationMaintenant qu'un groupe OH est présent, les autres hydrogènes cessent d'être chimiquement équivalents; Certains sont plus susceptibles d'être remplacés que d'autres. Et en plus, Oh exerce une influence directe à ce stade.
Nous avons trois substitutions dans différentes positions liées à l'OH: ortho attaques, pour et objectif. Notez que dans les trois, nous avons le cation sableux et ses structures de résonance. Dans les attaques ortho et pour, la charge positive à l'intérieur de la bague benzène est située juste dans le carbone lié à OH; Pendant l'attaque cible, cela ne se produit pas.
Oh en tant que groupe ortho et pour le réalisateur
OH présente la capacité de produire des électrons sur le ring par résonance et induction. Dans les deux, il peut aider à «dissiper» la charge positive du carbone avec lequel il est lié, en stabilisant en conséquence la structure. Au contraire, lorsque l'attaque cible se produit, OH ne peut pas stabiliser la charge positive de la même manière, la structure étant plus instable.
Par conséquent, ortho attaques et pour plus d'énergie favorisé. On dit alors que OH est un groupe de directeur ortho-pour, qui peut également activer l'anneau benzénique vers Sear. C'est-à-dire que le phénol réagit beaucoup plus rapidement que le benzène, qui est démontré en mesurant les vitesses de réaction.
Ariamines
 Structures de résonance pour l'aniline dans sa réaction de substitution électrophile aromatique. Source: V8RIK à l'anglais Wikipedia, CC BY-SA 3.0, via Wikimedia Commons
Structures de résonance pour l'aniline dans sa réaction de substitution électrophile aromatique. Source: V8RIK à l'anglais Wikipedia, CC BY-SA 3.0, via Wikimedia Commons Le cas des arilamines, comme celui de l'aniline (image supérieure), est similaire à celle du phénol. Notez que dans son mécanisme cette fois la stabilisation de la charge positive sur l'atome d'azote (H2N+=), aidant la substitution à être orientée vers des positions ortho et pour, comme avec l'OH.
Il peut vous servir: Théories de la basse acide: Arrhenius, Bronsted-Lowry, LewisMaintenant, l'aniline est plus réactive que le phénol contre la substitution électrophile. Parce que? Parce que l'atome d'azote est moins électronégatif que celui de l'oxygène, c'est pourquoi il donne plus facilement à sa paire d'électrons libres à l'anneau aromatique. L'oxygène, car il est plus électronégatif, donne l'une de ses paires d'électrons avec moins de "avidité".
De plus, le rayon atomique de l'azote est plus proche de celui du carbone. Cela a un impact sur le fait que la résonance se déroule en particulier entre les atomes avec des radios ou des tailles similaires. Par conséquent, la résonance entre le carbone et l'azote est un peu plus stable et efficace que celle entre le carbone et l'oxygène.
Chlorobenzène
Dans le chlorobenzène, en revanche, l'atome de Cl ralentit la substitution due à son électronégativité. Et bien qu'il soit également en mesure de donner des électrons en raison de la résonance à l'anneau, son rayon atomique est considérablement plus grand que celui du carbone, diminuant donc cette contribution électronique.
En réponse, le chlorobenzène réagit 50 fois plus lent que le benzène, car son anneau est désactivé à cause du chlore. Et aussi, attirant des électrons vers lui-même, le chlore est un groupe cible, donc les substitutions se produiront principalement dans cette position.
Les références
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. (dixe Édition.). Wiley Plus.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Morrison et Boyd. (1987). Chimie organique. (Cinquième édition). Addison-wesley iberoamericana.
- Wikipédia. (2020). Composé aromatique. Récupéré de: dans.Wikipédia.org
- Ed Vitz et al. (8 septembre 2020). Hydrocarbures aromatiques. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- Wyman Elizabeth. (2020). Hydrocarbures aromatiques: définition, exemple et utilisation. Étude. Récupéré de: étudier.com
- Boluda, C. J., Macías, m., & González Marrero, J. (2019). La complexité chimique de l'essence automobile. Science, ingénierie et applications,2(2), 51-79. Doi: doi.org / 10.22206 / CYAP.2019.V2i2.Pp51-79
- « Caractéristiques d'énergie thermique, obtention, transfert
- Structure d'oxyde d'aluminium, propriétés, utilisations, nomenclature »

