Structure d'oxyde d'aluminium, propriétés, utilisations, nomenclature
- 1293
- 207
- Lucas Schneider
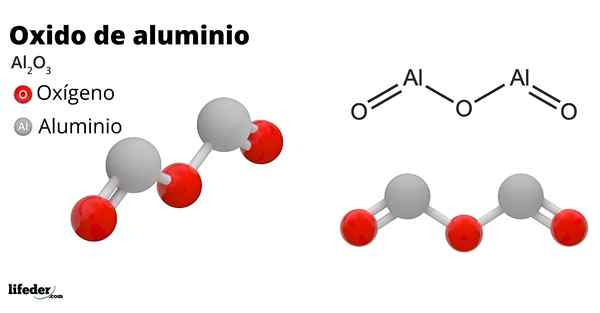
Il oxyde d'aluminium, Également appelé alumine, oxyde d'aluminium, corindon ou trioxyde d'aluminium, c'est un composé inorganique dont la formule chimique est à la2SOIT3. C'est un oxyde amphotéro, bien qu'il puisse devenir, en raison d'un traitement, un composé presque inerte.
Il a une grande dureté, une résistance à la corrosion et une forte résistance électrique. Ces propriétés, entre autres, ont permis à l'oxyde d'aluminium d'avoir de nombreuses applications, telles que: isolation électrique, matériaux abrasifs, implants osseux et dents, etc.
La bauxite est la principale source d'obtention d'oxyde d'aluminium. Le Corindon, en revanche, est un minéral d'oxyde d'aluminium qui est à l'état libre sous la forme de α-al2SOIT3. Le Corindon a une dureté de 9.0, et en raison de certaines impuretés, il produit des pierres précieuses, comme le saphir et le rubis.
L'électrolyse d'oxyde d'aluminium a servi de base à l'isolation en aluminium par Humphry Davy en 1808. Cette même méthode, avec quelques adaptations, est actuellement utilisée dans la production d'aluminium métallique.
[TOC]
Structure
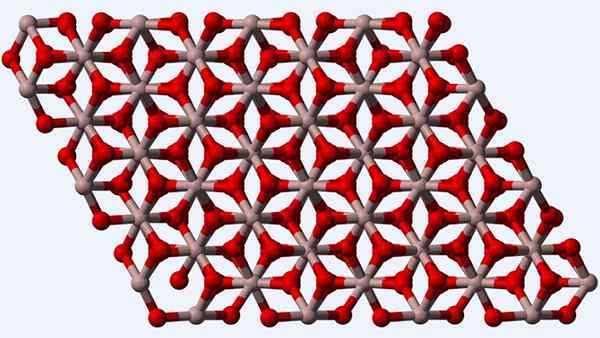 Structure cristalline de la phase α-AL2O3 ou Corindon
Structure cristalline de la phase α-AL2O3 ou Corindon Le Corindon ou la phase α-al2SOIT3, Parce qu'il s'agit d'un polymorphe thermodynamiquement plus stable pour l'oxyde d'aluminium, sa structure (image supérieure) est considérée comme le principal au moment de sa caractérisation. Cette structure est trigonale, avec les ions au3+ entouré de six ou2-, et donc, établissant octaedros al6 avec des interactions al-o u al-o.
En plus du Corindón, Al2SOIT3 Il existe également comme d'autres polymorphes métastables, notamment: γ-al2SOIT3 et η-al2SOIT3 (cubic), θ-at2SOIT3 (monoclinique), χ-al2SOIT3 (hexagonal), κ-al2SOIT3 (Ortorrombique) et δ-al2SOIT3 (Tétragonal ou ortorrombique).
Comme l'al2SOIT3, Les octaèdres "se brisent" dans Tetrahedros al4 o pentaedros alo5. Une fois fondu et refroidi à nouveau, vous pouvez obtenir un oxyde d'aluminium vitreux, c'est-à-dire amorphe, avec des mélanges de polyède alm5 déjà6.
Il peut vous servir: einstenio (s): structure, propriétés, obtention, utilisationsPropriétés d'oxyde d'aluminium
 Revêtement d'oxyde d'aluminium
Revêtement d'oxyde d'aluminium Apparence physique
Poudre cristalline solide ou blanche
Masse molaire
101.96 g / mol
Odeur
Toilettes
Densité
3.798 g / cm3
Point de fusion
2072 ºC
Point d'ébullition
2977 ºC
Solubilité
Insoluble dans tous les solvants, y compris l'eau.
Conductivité thermique
30 w · m-1· K-1. Malgré son utilisation en céramique, il a une conductivité thermique relativement élevée.
Indice de réfraction
1.768-1.760
Dureté
C'est un composé qui présente une dureté très élevée, avec une valeur de 9.0 sur l'échelle de dureté MOHS sous forme d'oxyde d'aluminium α (Corindón) (Corindón).
Résistivité électrique
À 300 ° C: 1.2 x 1013 Ohms · cm. L'oxyde d'aluminium ou d'alumine est donc un isolant électrique.
Réactivité
L'al2SOIT3 En dépit de réagir faiblement avec les alcalis, et dans une plus grande mesure avec les acides, il est considéré comme un amphoter chimique. Cependant, lorsqu'il est chauffé à plus de 800 ° C, il acquiert un état presque inerte à l'action des acides.
Cet oxyde est responsable de la protection de l'aluminium devant les agents corrosifs environnementaux, car il couvre fermement la surface du métal sans s'effondrer ni fissure.
Nomenclature
La nomenclature d'Al2SOIT3 est simple. Systématiquement connu sous le nom de trioxyde de diaununum. Comme cet oxyde d'aluminium existe, dans sa nomenclature en stock, le métal Valence (III) n'est pas spécifié. De plus, son nom est traditionnellement résumé à l'oxyde d'aluminium, en ayant une seule valence.
Utilisations / applications
Verre
L'oxyde d'aluminium intervient dans l'élaboration du verre d'aluminium-silicato. Ce verre réfractaire, résistant aux chocs thermiques, peut être utilisé à des températures plus élevées que le verre de bore-silicate; Bien qu'il ait une résistance chimique plus faible.
L'ajout d'une petite quantité de magnésie transforme le verre opaque d'alumine en translucide, pouvoir être utilisé comme récipient à gaz dans les ampoules de vapeur de sodium haute pression. Il est également utilisé dans la préparation de suspensions de revêtement de certains types de lampes fluorescentes.
Peut vous servir: Rodio: histoire, propriétés, structure, utilisations, risqueCatalyseur
L'alumine activée a une caractéristique granulaire et poreuse qui peut avoir une activité catalytique ou servir de soutien à l'activité d'autres catalyseurs. Parmi d'autres processus, l'alumine intervient dans la catalyse de la polymérisation de l'oxyde d'éthylène.
Activité microbicide
Les particules d'oxyde de nano-aluminium adhèrent à la surface des bactéries, provoquant leur mort. De même, un effet similaire sur le champignon du genre Candida a été mis en évidence.
Isolant électrique
L'oxyde d'aluminium a une résistivité électrique élevée, ce qui lui donne la possibilité d'agir comme isolant électrique. Par conséquent, il est utilisé dans les packages de circuits intégrés. Il est également utilisé dans les appareils supraconducteurs et comme condenseur diélectrique ou condensateur. De plus, il est utilisé comme isolant dans les bougies électriques.
Abrasif
 Le Corindon, le cristallin et le plus dur de l'oxyde d'aluminium, sert à construire des outils abrasifs. Source: Rob Lavinsky, Irocks.com-cc-by-sa-3.0, cc by-sa 3.0, via Wikimedia Commons
Le Corindon, le cristallin et le plus dur de l'oxyde d'aluminium, sert à construire des outils abrasifs. Source: Rob Lavinsky, Irocks.com-cc-by-sa-3.0, cc by-sa 3.0, via Wikimedia Commons La dureté élevée du minéral Corindon lui permet d'être utilisée comme abrasive, de moins de coûts que les diamants, dans l'industrie et dans le forage pétrolier.
Le Corindon acquiert la forme précieuse de la pierre, comme le rubis rouge, en raison de la contamination par chrome; ou comme un saphir bleu, en raison de la pollution en fer et en titane. De nombreux types de papier de verre utilisés en métal et en bois ont des cristaux d'oxyde d'aluminium.
La ténacité ou la capacité d'éviter la rupture de l'oxyde d'aluminium augmente avec l'ajout de zircone ou de carbure de silicium, ce qui lui permet d'être utilisé dans les outils industriels de coupe. De plus, l'oxyde d'aluminium est utilisé dans les crèmes dentaires pour le polissage des dents.
Peut vous servir: chromate de zinc: structure, propriétés, obtention, utilisationsCertaines présentations d'oxyde d'aluminium sont également utilisées comme abrasifs par les dermatologues dans le traitement de certaines affections cutanées.
Déshumidificateur au gaz
L'oxyde d'aluminium est un composé avec une avide par eau, il peut donc être utilisé pour l'extraire des courants gazeux.
Ignifuge
Les nano-particules de l'hydroxyde d'oxyde d'aluminium (Bohemita) agissent comme un dissipateur de chaleur, libérant de l'eau et retardant l'apparence des flammes.
Implants de tissu dur
L'oxyde d'aluminium est un composé d'une grande dureté, chimiquement inerte et résistant à la corrosion, en plus d'avoir une couleur blanche. Pour ces qualités, il est utilisé comme substitut aux tissus durs tels que les os et les dents. De même, le matériau construit avec de l'oxyde d'aluminium a été utilisé dans le remplacement des articulations.
Obtention
 Échantillon de bauxite. Source: Max.Kit, cc by-sa 4.0, via Wikimedia Commons
Échantillon de bauxite. Source: Max.Kit, cc by-sa 4.0, via Wikimedia Commons La bauxite est le principal minéral pour obtenir de l'oxyde d'aluminium, formé par le mélange de trois minéraux: gibbsite, laboehmita et diaspora.
L'oxyde d'aluminium est extrait de ses minéraux par la procédure Bayer. Il s'agit de la réaction de bauxite chaude avec l'hydroxyde de sodium, une réaction produite par l'aluminate de sodium [Naal (OH)4]].
Lorsque la solution précédente est refroidie, la précipitation de l'hydroxyde d'aluminium est produite sous forme solide. Ensuite, cet hydroxyde est chauffé jusqu'à 1100 ° C, produisant de l'oxyde d'aluminium.
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2020). Oxyde en aluminium. Récupéré de: dans.Wikipédia.org
- Centre national d'information sur la biotechnologie. (2020). Oxyde en aluminium. PubChem Comunund Résumé pour CID 9989226. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Kushagri S. et al. (2019). Potentialité antivirale et antimicrobienne des nano médicaments: oxyde d'aluminium nanoparticule. Récupéré de: ScienceDirect.com
- Les éditeurs d'Enyclopaedia Britannica. (2020). Alumine. Récupéré de: Britannica.com
- Lohninger Hans. (15 août 2020). Oxyde en aluminium. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- « Mécanisme de substitution électrophile aromatique et exemples
- 30 exemples d'éthique et de morale dans la vie quotidienne »

