Structure de sulfure de calcium (CAS), propriétés, obtention, utilisations
- 3707
- 170
- Eva Henry
Il Sulfure de calcium C'est un solide inorganique formé par l'élément de calcium (CA) et l'élément de soufre (s), de la formule chimique est CAS. C'est un solide soluble blanc jaunâtre dans l'eau, qui se trouve dans la nature dans certains volcans et dans certaines météorites sous la forme d'un minéral appelé Oldhamite.
Le CAS lors de la dissolution dans l'eau forme divers composés parce que les ions de soufre2- devient ion sh- et des ions oh sont formés-. La solution résultante est alcaline. Ce composé est utilisé comme base pour les composés luminescents ou qui produisent une lumière visible dans certaines conditions. Ces matériaux sont également utilisés dans les peintures légères.
 Le sulfure de calcium Cas a été trouvé dans certaines météorites. Auteur: р жравёв. Source: Pixabay.
Le sulfure de calcium Cas a été trouvé dans certaines météorites. Auteur: р жравёв. Source: Pixabay. Le CAS a été considéré comme un médicament possible pour traiter les problèmes cardiaques et les vaisseaux sanguins tels que l'hypertension ou la haute pression, qui est une maladie qui affecte une grande partie de la population mondiale.
Avec du sulfure de calcium, d'autres composés tels que le nitrate de calcium et le carbonate de calcium peuvent être obtenus. Il doit être manipulé avec prudence et en contact avec l'humidité de l'atmosphère peut produire H2S qui est très toxique.
[TOC]
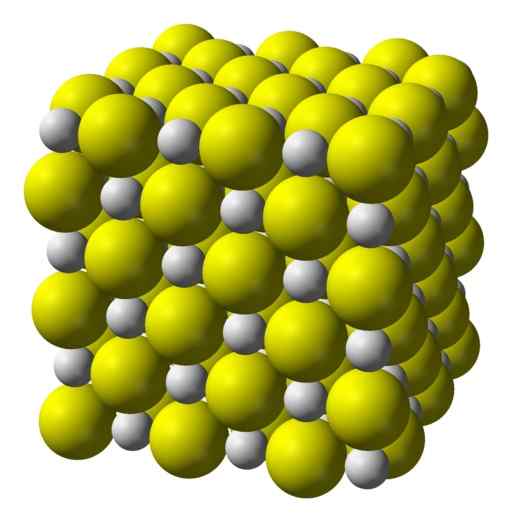
Structure
Le sulfure de calcium est un composé hautement ionique formé par un ion calcium CA2+ et un ion sulfure S2-.
Cristalliser dans une structure cubique comme le sel de roche.
 Structure cristalline cubique du sulfure de calcium. Jaune = soufre; Blanc = calcium. Benjah-Bmm27 / Domaine public. Source: Wikimedia Commons.
Structure cristalline cubique du sulfure de calcium. Jaune = soufre; Blanc = calcium. Benjah-Bmm27 / Domaine public. Source: Wikimedia Commons. Nomenclature
- Sulfure de calcium
Propriétés physiques
État physique
Solide cristalline blanc jaunâtre, cristaux cubiques tels que le chlorure de sodium.
Poids moléculaire
72 144 g / mol
Point de fusion
2528 ºC
Densité
2,59 g / cm3
Solubilité
Soluble dans l'eau. Insoluble dans l'éthanol.
Propriétés chimiques
Solution aqueuse
Lors de la dissolution dans l'eau, le CAS est séparé en ses ions CA de calcium 2+ et sulfure s2-. Ce dernier dans l'eau prend un proton et devient l'ion hydrosulfuro SHH- Libérer un ion Hydroxyle OH-.
Peut vous servir: tamiséS2- + H2Ou ⇔ sh- + Oh-
Par conséquent, les solutions de sulfure de calcium sont alcalines (elles ont un pH de base) et n'ont pas d'ions S2- Mais sh-.
Ce n'est que dans le cas où une grande quantité d'alcali est ajoutée à la solution telle que l'hydroxyde de sodium NaOH. L'équilibre se déplace vers la formation d'ions soufrés S2-.
 Le sulfure de calcium se dissout dans l'eau formant d'autres composés. Auteur: Clker-Free-Vector-Images. Source: Pixabay.
Le sulfure de calcium se dissout dans l'eau formant d'autres composés. Auteur: Clker-Free-Vector-Images. Source: Pixabay. Le sh- Vous pouvez prendre un autre proton h+ d'eau, formant du sulfure d'hydrogène, qui est un composé très toxique.
Shot- + H2Ou ⇔ h2S + oh-
Par conséquent, de petites quantités de H se forment dans l'eau2S et en étant exposé à l'humidité de l'environnement, le CAS dégage une odeur désagréable typique du sulfure d'hydrogène.
Composés présents lors de la dissolution dans l'eau
Le résultat des réactions en eau précédemment indiquées est que le Ca (Sh) est formé2, Ca (oh)2 et ca (sh) (oh).
CAS + H2O → Ca (sh) (OH)
Ca (sh) (oh) + h2O → Ca (OH)2 + H2S
Réaction acide
Les mêmes réactions qui se produisent dans l'eau font réagir les Cas avec les acides formant H2S.
CAS + 2 HCL → CACL2 + H2S
Autres réactions
Si une solution de sulfure de calcium avec le soufre est chauffée, les ions polysulfures sont obtenus42- et s32-.
Si le CAS est chauffé dans de l'air sec ou de l'oxygène pur, le composé est oxydé au boîtier de sulfite de calcium3 Puis au boîtier de sulfate de calcium4:
2 CAS + 3 O2 → Cas3
2 cas3 + SOIT2 → Cas4
Avec des agents oxydants tels que le chlorate kclo potassium3, Nitrate de kno potassium3 ou dioxyde de plomb2 Des réactions violentes se produisent.
Obtention
Le sulfure de calcium peut être préparé en calcinant (chauffage à très haute température) Le calcium (CA) et le (s) (s) dans l'atmosphère inerte, c'est-à-dire qu'ils ne sont pas présents par exemple l'oxygène ou la vapeur d'eau.
Il peut vous servir: acide chloro (HCLO2)Ca + S + chaleur → CAS
Peut également être obtenu en chauffant le cas de sulfate de calcium4 Avec du charbon:
Cas4 + 2 C → CAS + 2 CO2
Cependant, dans ce dernier cas, une maison pure n'est pas obtenue, car elle réagit en plus avec l'affaire4 formant Cao et donc2.
CAS est également généré en brûlant les déchets de charbon.
Présence dans la nature
Le CAS est naturellement présent dans le minéral Oldhamite. Ceci est une composante de certaines météorites et est importante par la recherche scientifique qui est effectuée sur le système solaire.
On pense que l'Oldhamite a été formée par condensation dans la nébuleuse qui a créé le système solaire. Il est également présent dans les volcans.
 Le sulfure de calcium Cas est dans le minéral Oldhamite, qui a été trouvé dans certaines météorites. Leon Hupperichs / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 3.0). Source: Wikimedia Commons.
Le sulfure de calcium Cas est dans le minéral Oldhamite, qui a été trouvé dans certaines météorites. Leon Hupperichs / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 3.0). Source: Wikimedia Commons. De plus, le sulfure de calcium est naturellement produit par la réduction du cas4 (plâtre) peut-être par l'action des bactéries.
Applications
Dans les matériaux légers
L'une des utilisations les plus répandues du sulfure de calcium a été comme base de composés légers. Ce sont des substances qui émettent une lumière visible dans certaines circonstances.
Dans les composés luminescents de CAS, cela agit comme une base et des activateurs sont ajoutés à la structure telles que les chlorures de certains éléments tels que cerio (CE3+) et Europio (UE2+).
Le matériau résultant de l'Union CAS et de l'activateur est utilisé, par exemple, dans des écrans de tubes à rayons cathodiques qui composent les anciens écrans d'ordinateurs ou d'ordinateurs ou d'anciens appareils télévisés.
 Les moniteurs d'ordinateurs anciens avaient des tubes de rayons de cathode dans lesquels parfois des composés luminescents de sulfure de calcium et d'activateurs sont utilisés parfois. Auteur: Andreas160578. Source: Pixabay.
Les moniteurs d'ordinateurs anciens avaient des tubes de rayons de cathode dans lesquels parfois des composés luminescents de sulfure de calcium et d'activateurs sont utilisés parfois. Auteur: Andreas160578. Source: Pixabay. Ils sont également utilisés dans les lampes actuelles des diodes émettrices de lumière, ou LED (acronyme pour l'anglais Diodes émettrices légères).
Peut vous servir: ayaroína Lampe à LED. Certains peuvent contenir des composés luminescents de sulfure de calcium. Aucun auteur lisible par machine fourni. APPEUR assumé (basé sur les réclamations du droit d'auteur). / Cc by-sa (http: // CreativeCommons.Org / licences / by-sa / 3.0 /). Source: Wikimedia Commons.
Lampe à LED. Certains peuvent contenir des composés luminescents de sulfure de calcium. Aucun auteur lisible par machine fourni. APPEUR assumé (basé sur les réclamations du droit d'auteur). / Cc by-sa (http: // CreativeCommons.Org / licences / by-sa / 3.0 /). Source: Wikimedia Commons. Ces matériaux sont également utilisés dans des peintures et des vernis légers.
En médecine
Le sulfure de calcium a été considéré dans les études médicales comme un médicament pour traiter l'hypertension artérielle (haute pression dans les artères). Il s'agit d'une maladie qui affecte le système cardiovasculaire de nombreuses personnes (coeur et vaisseaux sanguins).
CAS est considéré comme un "donateur" de H2S. Cela joue un rôle important dans la régulation du ton ou de la force des vaisseaux sanguins, de sorte que l'administration CAS pourrait être un remède possible pour traiter l'hypertension.
 Le sulfure de calcium a été étudié comme un possible remède pour la haute pression du système cardiovasculaire des malades. Auteur: Mohamed Hassan. Source: Pixabay.
Le sulfure de calcium a été étudié comme un possible remède pour la haute pression du système cardiovasculaire des malades. Auteur: Mohamed Hassan. Source: Pixabay. Dans l'obtention d'autres composés
Le sulfure de calcium permet de préparer d'autres composés tels que le nitrate de calcium CA (non3)2:
CAS + 2 HNO3 → CA (non3)2 + H2S
Il a également été utilisé pour obtenir du carbonate de calcium Caco3. Pour cela, une solution aqueuse de CAS est soumise au charbon2:
CAS + H2Ou + CO2 → H2S + Caco3
Autres applications
Le sulfure de calcium est également utilisé comme additif pour les lubrifiants et comme agent de flottaison dans l'extraction minérale.
Des risques
Le sulfure de calcium peut provoquer une irritation de la peau, des yeux et des voies respiratoires. Doit être manipulé avec des précautions et des outils de sécurité appropriés.
C'est un composé très toxique pour la vie aquatique, il est donc dangereux pour ces environnements.
Les références
- Coton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley & Sons.
- Diriger, D.R. (éditeur). (2005). CRC Handbook of Chemistry and Physics. 85e CRC Press.
- Ropp, r.C. (2013). Groupe 16 (O, S, SE, TE) Composés de la Terre alcaline. Calcium sulfuré. Dans l'encyclopédie des composés terrestres alcalins. Récupéré de ScienceDirect.com.
- Li, et.F. et al. (2009). Sulfure de calcium (CAS), au donneur du sulfure d'hydrogène (H (2) s): un nouveau drarigue antihypertendant? MED HYPOTHES, 2009 SEP; 73 (3): 445-7. NCBI a récupéré.NLM.NIH.Gouvernement.
- Maison J.ET. et maison, k.POUR. (2016). Soufre, sélénium et tellurium. Se produire en soufre. En chimie inorganique descriptive (troisième édition). Récupéré de ScienceDirect.com.
- OU.S. Bibliothèque nationale de médecine. (2019). Sulfure de calcium. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- Bière, m. et al. (2014). Conversion du sulfure de calcium en carbonate de calcium pendant le processus de récupération du soufre élémentaire à partir des déchets de gypse. Waste Manag, 2014 nov; 34 (11): 2373-81. NCBI a récupéré.NLM.NIH.Gouvernement.
- « Caractéristiques de recherche quantitative, techniques, exemples
- Propriétés du silicate de calcium, structure, obtenant, utilisations »

