Esters
- 2592
- 103
- Anaïs Julien
 Les esteres sont des composés organiques qui ont une composante de l'acide carboxylique et un autre alcool
Les esteres sont des composés organiques qui ont une composante de l'acide carboxylique et un autre alcool Que sont les esters?
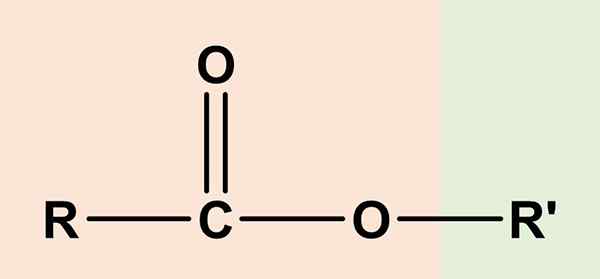
Les esters Ce sont des composés organiques qui ont un composant acide carboxylique et un autre alcool. Sa formule chimique générale est RCO2R' ou rcoor'. Le côté droit, RCOO, correspond au groupe carboxyle, tandis que la droite, ou' C'est l'alcool. Les deux partagent un atome d'oxygène et partagent une certaine similitude avec les éthers (ror ').
Pour cette raison, l'acétate d'éthyle, ch3COOCH2Ch3, Le plus simple des esters, était considéré comme le Éther acétique ou vinaigre, Et à partir de là l'origine étymologique du nom «ester». De sorte qu'un ester consiste en remplacement de l'hydrogène acide du groupe COOH, par une location d'alcool à partir d'un alcool.
Où sont les esters?
À partir des sols de la chimie organique, il existe de nombreuses sources naturelles. L'odeur agréable des fruits, comme les bananes, les poires et les pommes, est le produit de l'interaction des esters avec de nombreux autres composants. Ils se trouvent également sous forme de triglycérides dans les huiles ou les graisses.
Notre corps fabrique des triglycérides d'acides gras, qui ont de longues chaînes gazéiquées et de l'alcool de glycérol. Ce qui différencie certains esters d'autres se trouvent à la fois dans R, la chaîne de la composante acide, comme dans R ', celle de la composante alcoolique.
Un ester de poids moléculaire faible doit avoir peu de carbones en r et r ', tandis que d'autres, comme les cires, ont de nombreux carbones en particulier dans R', la composante alcoolique, et donc les poids moléculaires élevés.
Cependant, tous les esters ne sont pas strictement organiques. Si l'atome du groupe Carbonhel du groupe carbonyle est remplacé par un phosphore, alors Rpoor aura '. Ceci est connu sous le nom d'ester de phosphate et est une importance cruciale dans la structure de l'ADN.
Ainsi, chaque fois qu'un atome peut être lié efficacement au carbone ou à l'oxygène, comme le soufre (RSOOR '), il peut par conséquent former un ester inorganique.
Propriétés des estres
Les esters ne sont pas des acides ou des alcools, donc ils ne se comportent pas comme tels. Ses points de fusion et d'ébullition, par exemple, sont inférieurs à ceux avec des poids moléculaires similaires, mais plus proches des valeurs de celles des aldéhydes et des cétones.
Acide butanoïque, cho3Ch2Ch2COOH, a un point d'ébullition de 164 ° C, tandis que l'acétate d'éthyle, ch3COOCH2Ch3, de 77.1er C.
En dehors de l'exemple récent, les points d'ébullition du 2-méthylbutane3Ch (ch3) Ch2Ch3, Acétate de méthyle, cho3COOCH3, et 2-butanol, Cho3,Ch (oh) ch2Ch3, Ils sont les suivants: 28, 57 et 99º C. Les trois composés ont des poids moléculaires de 72 et 74 g / mol.
Les esters de pesos moléculaires faibles ont tendance à être volatils et ont des odeurs agréables, c'est pourquoi leur contenu en fruits leur donne leurs parfums familiaux. D'un autre côté, lorsque leurs poids moléculaires sont élevés, ils sont des solides cristallins incolore et inodore, ou selon leur structure, ils peuvent présenter des caractéristiques grasses.
Solubilité dans l'eau
Les acides et les alcools carboxyliques sont généralement solubles dans l'eau, à moins qu'ils aient un caractère hydrophobe élevé dans leurs structures moléculaires. Il en va de même pour les esters. Lorsque r ou r 'sont des chaînes courtes, l'ester peut interagir avec les molécules d'eau par dipole-dipolo et forces des forces de Londres.
Peut vous servir: composé chimiqueC'est parce que les esters sont des accepteurs de ponts d'hydrogène. Comme? Pour ses deux atomes d'oxygène rcoor '. Les molécules d'eau peuvent former des ponts d'hydrogène avec n'importe lequel de ces oxygène. Mais lorsque les chaînes R ou R sont très longues, ils repoussent l'eau dans leur environnement, ce qui rend impossible leur dissolution.
Un exemple évident de cela se produit avec des esters triglycérides. Leurs chaînes latérales sont longues et rendent les huiles et les graisses insolubles dans l'eau, à moins qu'ils ne soient en contact avec un solvant moins polaire, plus lié à ces chaînes.
Réaction d'hydrolyse
Les esteres peuvent également réagir avec les molécules d'eau dans ce qui est connu sous le nom de réaction d'hydrolyse. Cependant, ils ont besoin d'un environnement acide ou de base pour favoriser le mécanisme de ladite réaction:
Rcoor ' + H2SOIT RCOOh + R'oH
(Moitié acide)
La molécule d'eau est ajoutée au groupe carbonyle, c = o. L'hydrolyse acide est résumé lors du remplacement de chaque r 'de la composante alcoolique par un OH de l'eau. Notez également comment l'ester "se brise" dans ses deux composants: l'acide carboxylique, RCOOH et R'oh alcool.
Rcoor ' + Oh- => RCOSOIT- + R'oH
(Support de base)
Lorsque l'hydrolyse est réalisée dans un milieu de base, une réaction irréversible se produit connue sous le nom saponification. Ceci est très employé et est la pierre angulaire de l'élaboration des savons artisanaux ou industriels.
Le rcoo- C'est l'anion carboxylate, stable, qui est associé électrostatiquement au cation prédominant au milieu.
Si la base utilisée est naOH, le sel est formé. Lorsque l'ester est un triglycéride, qui a par définition trois chaînes latérales, trois sels d'acide gras, rcoone et alcool de glycérol se forment.
Réaction de réduction
Les esters sont des composés très oxydés. Cela signifie qu'il a plusieurs liaisons covalentes avec l'oxygène. En éliminant les liaisons C-O, une rupture se produit qui finit par séparer les composants acides et alcoolisés; Et encore plus, l'acide est réduit à une manière moins oxydée, à un alcool:
Rcoor '=> rch2Oh + R'oh
C'est la réaction de réduction. Un agent réducteur fort est nécessaire, comme le lithium et l'hydrure d'aluminium, lialh4, et d'un milieu acide qui favorise la migration d'électrons. Les alcools sont les plus petites formes, c'est-à-dire celles qui ont des liaisons moins covalentes avec l'oxygène (un seul: c-oh).
Les deux alcools, RCH2Oh + r'oh, proviennent des deux chaînes respectives de l'ester rcoor d'origine '. Ceci est une méthode de synthèse des alcools d'ajout de valeur de ses esters.
Par exemple, si vous vouliez fabriquer un alcool d'esters exotiques, ce serait un bon itinéraire à cette fin.
Réaction de transtérification
Les esters peuvent être transformés en autres s'ils réagissent en milieux acides ou de base avec des alcools:
Rcoor ' + R "Oh RCOOu " + R'oH
Structure d'ester
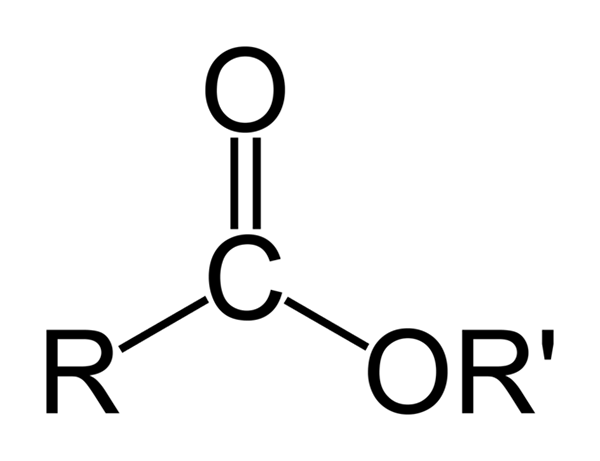 Structure chimique générale des esters organiques. Source: Ben Mills via Wikipedia
Structure chimique générale des esters organiques. Source: Ben Mills via Wikipedia L'image supérieure représente la structure générale de tous les esters organiques. Notez que R, le groupe carbonyle C = O et ou ', forment un triangle plat, le produit de l'hybridation SP2 de l'atome de carbone central. Cependant, d'autres atomes peuvent adopter d'autres géométries, et leurs structures dépendent de la nature intrinsèque de r ou r '.
Peut vous servir: Nitrates: propriétés, structure, nomenclature, formationSi R ou R 'sont de simples chaînes d'alQulicas, par exemple, du type (choisissez2)nCh3, Vous aurez l'air zigzagueada dans l'espace. C'est le cas de Pentilo Butanoat3Ch2Ch2COOCH2Ch2Ch2Ch2Ch3.
Mais dans l'un des carbones de ces chaînes, une branche ou une insaturation a pu être trouvée (c = c, C≡C), qui modifierait la structure globale de l'ester. Et pour cette raison, ses propriétés physiques, telles que la solubilité et ses points d'ébullition et de fusion, varient avec chaque composé.
Par exemple, les graisses insaturées ont des liens doubles dans leurs chaînes R, qui influencent négativement les interactions intermoléculaires. En conséquence, leurs points de fusion descendent, jusqu'à ce qu'ils soient liquides ou huiles, à température ambiante.
Accepteur du pont hydrogène
Bien que l'image du squelette des esters se démarque davantage, ce sont les chaînes R et R responsables de la diversité dans leurs structures.
Cependant, une caractéristique structurelle des esters est méritée du triangle: ce sont des accepteurs de ponts d'hydrogène. Comme? Par oxygène des groupes carbonyle et alcoxydes (le-ou ').
Ceux-ci ont des paires d'électrons libres, qui peuvent attirer des atomes d'hydrogène partiellement positifs des molécules d'eau.
Par conséquent, c'est un type spécial d'interactions dipol-dipole. Les molécules d'eau s'approchent de l'ester (si les chaînes r o r ne pas empêchent et que les ponts sont formés c = o-h2Ou ou oh2-OU '.
Nomenclature des esters
Pour nommer de manière appropriée un ester, c'est nécessaire. Aussi, toute branche, substituant ou insaturation possible.
Une fois cela fait, le nom du r 'du groupe alcoxide -ou' le suffixe est ajouté -ILO, Tandis que la chaîne de groupe carboxilo -coor r, le suffixe -Ato. Tout d'abord, la section R est mentionnée, suivie du mot «de» puis du nom de la section r «section».
Par exemple, Cho3Ch2Ch2COOCH2Ch2Ch2Ch2Ch3 Il a cinq carbones sur le côté droit, c'est-à-dire que ce sont ceux qui correspondent à r '. Et sur le côté gauche, il y a quatre atomes de carbone (y compris le groupe carbonyle C = O).
Par conséquent, R 'est un groupe de Pentil, et R A Butane (pour inclure le carbonyle et considérer la chaîne principale). Ensuite, pour donner un nom au composé, il suffit d'ajouter les suffixes correspondants et de les nommer dans le bon ordre: ButaneAto deILO.
Comment nommer le composé suivant: ch3Ch2COOC (CH3)3? La chaîne -c (CHO3)3 correspond au substituant alquilical recto-butyl. Comme le côté gauche a trois carbones, c'est un "propane". Son nom est alors: propaneAto de tert-maisILO.
Comment les esters sont-ils formés?
Estérification
Il existe de nombreux itinéraires pour synthétiser l'ester, dont certains peuvent même être nouveaux. Cependant, ils convergent tous dans le fait que le triangle de l'image de la structure doit être formé, c'est-à-dire le lien co-o. Pour cela, il doit partir d'un composé qui a auparavant le groupe carbonyle: en tant qu'acide carboxylique.
Et que devrait être lié à l'acide carboxylique? À un alcool, sinon il n'aurait pas le composant alcoolique qui caractérise les esters. Cependant, les acides carboxyliques nécessitent de la chaleur et de l'acidité pour permettre au mécanisme de réaction de continuer. L'équation chimique suivante représente ce qui précède:
Peut vous servir: hydrure en aluminium (ALH3): structure, propriétés, utilisationsRcooh + r'oh rcoor '+ h2SOIT
(Moitié acide)
Ceci est connu comme estérification.
Par exemple, les acides gras peuvent estérifier avec du méthanol, CHO3Oh, pour remplacer leurs acides par des groupes méthyle, de sorte que cette réaction peut également être considérée comme méthylation. Il s'agit d'une étape importante lors de la détermination du profil d'acide gras de certaines huiles ou graisses.
Esteres de chlorures acides
Une autre façon de synthétiser les esters provient de chlorures acyl, rCOCL. En eux, au lieu de remplacer un groupe Hydroxyle OH, l'atome CL est remplacé:
Rcocl + r'oh => rcoor '+ hcl
Et contrairement à la stérification d'un acide carboxylique, l'eau n'est pas libérée mais l'acide chlorhydrique.
D'autres méthodes sont disponibles dans le monde de la chimie organique, comme l'oxydation de Baeyer-Villiger, qui utilise des acides de peroxy (RCOOOH).
ESTRES utilise
 Les esteres sont utilisés pour diverses choses, comme la fabrication de bougies
Les esteres sont utilisés pour diverses choses, comme la fabrication de bougies Parmi les principales utilisations des esters sont:
- Dans les bougies ou bougies d'élaboration, comme l'image supérieure. À cette fin, de très longues esters de chaîne latérale sont utilisées.
- En tant que conservateurs en médecine ou nourriture. Cela est dû à l'action des parabènes, qui ne sont rien de plus que des estéres d'acide para-hydroxibenzoïque. Bien qu'ils conservent la qualité du produit, il existe des études qui remettent en question son effet positif sur le corps.
- Ils servent à la fabrication de parfums artificiels qui imitent l'odeur et le goût de nombreux fruits ou fleurs. De sorte que les esters sont présents dans les friandises, la crème glacée, les parfums, les cosmétiques, les savons, les shampooings, entre autres produits commerciaux qui méritent des arômes ou des saveurs attrayantes.
- Les esters peuvent également fournir un effet pharmacologique positif. Pour cette raison. L'aspirine est l'un des exemples les plus simples de ces esters.
- Les esters liquides, comme l'acétate d'éthyle, sont des solvants adéquats pour certains types de polymères, tels que la nitrocellulose et un large éventail de résines.
Exemples d'esters
Certains exemples d'esters supplémentaires sont les suivants:
- Butanato de pentilo, ch3Ch2Ch2COOCH2Ch2Ch2Ch2Ch3, qui sent albicoque et poires.
- Acétate de vinyle, cho3COOCH2= Ch2, à partir de laquelle le polymère à acétate de polyvinyle se produit.
- Isopentilo pentanoato, ch3Ch2Ch2Ch2COOCH2Ch2Ch (ch3)2, qui imite le goût des pommes.
- Propanoate d'éthyle, ch3Ch2COOCH2Ch3.
- Propyl Metanoate, Hcooch2Ch2Ch3.
Les références
- T.W. Graham Salomons, Craight B. Fryhle. Chimie organique. (Dixième édition, p 797-802, 820) Wiley Plus.
- Carey, F. POUR. Organic Chemistry (2006) Sixième édition. Éditorial de Mc Graw Hill-
- CHIMISTER BOOLISTexts. Nomenclature d'essers. Récupéré de: Chem.Bibliothèque.org
- Administrer. (19 septembre 2015). Esters: sa nature chimique, ses propriétés et ses utilisations. Tiré de: pur chimique.com
- Chimie organique dans notre vie quotidienne. (9 mars 2014). Quelles sont les utilisations des esters? Récupéré de: Gen2chemistAssignment.Weebly.com
- Chimie.Net (2018). Exemples d'esters. Récupéré de: chimiques.filet
- Paz María de Lourdes Cornejo Arteaga. Applications principales des esters. Tiré de: UAEH.Édu.mx
- Jim Clark. (Janvier 2016). Introduction Esters. Tiré de: Chemguide.co.ROYAUME-UNI

