Composants de la solution isotonique, préparation, exemples
- 3597
- 982
- Anaïs Julien
Ongle solution isotonique C'est celui qui présente la même concentration de soluté par rapport à une solution séparée ou isolée par un bug semi-perméable. Cette barrière permet au solvant de transférer, mais pas toutes les particules de soluté.
En physiologie, cette solution isolée se réfère au liquide intracellulaire, c'est-à-dire à l'intérieur des cellules; Tandis que la barrière semi-perméable correspond à la membrane cellulaire, formée par un bilay lipidique.
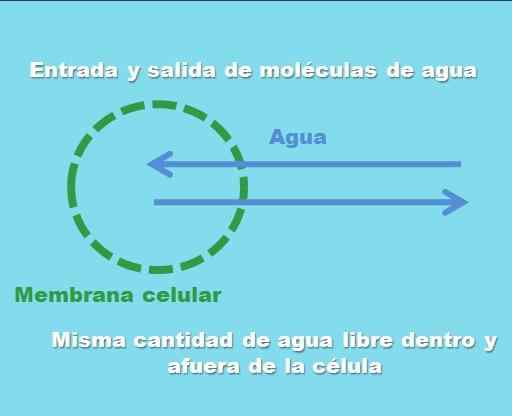
 Interaction d'une cellule avec une solution isotonique. Source: Gabriel Bolívar.
Interaction d'une cellule avec une solution isotonique. Source: Gabriel Bolívar. L'image supérieure illustre ce que l'on entend par une solution isotonique. La "concentration" de l'eau est la même à l'intérieur et à l'extérieur de la cellule, donc leurs molécules entrent ou sortent à travers la membrane cellulaire avec des fréquences égales. Par conséquent, si deux molécules d'eau entrent dans la cellule, deux d'entre elles partiront simultanément vers le milieu extracellulaire.
Cet état, appelé isotonicité, n'a lieu que lorsque le milieu aqueux, à l'intérieur et à l'extérieur de la cellule, contient le même nombre de particules de soluté dissoutes. Ainsi, une solution sera isotonique si la concentration de ses solutés est similaire à celle du fluide ou du milieu intracellulaire. Par exemple, la solution saline à 0,9% est isotonique.
[TOC]
Composants des solutions isotoniques
Pour qu'il y ait une solution isotonique, il doit d'abord s'assurer que l'osmose se produit dans la solution ou le solvant. Cela n'est possible que si une barrière semi-perméable est présente, ce qui permet aux molécules de solvant de le transférer, mais pas à celles de soluté, en particulier des solutés à charge électrique, des ions.
Ainsi, le soluté ne peut pas se propager des régions plus concentrées aux régions plus diluées. Au lieu de cela, ce seront les molécules d'eau qui se déplaceront d'un endroit à un autre, traverseront la barrière semi-perméable et se dérouleront l'osmose. Dans les systèmes aqueux et biologiques, cette barrière est par excellence la membrane cellulaire.
Peut vous servir: compétition (biologie): caractéristiques, types, exemplesAyant une barrière semi-perméable et un milieu de solvant, la présence d'ions ou de sels dissous dans les deux milieux est également nécessaire: l'interne (à l'intérieur de la barrière) et l'extérieur (en dehors de la barrière).
Si la concentration de ces ions est la même des deux côtés, il n'y aura pas d'excès ou de déficit de molécules d'eau pour les résoudre. C'est-à-dire que le nombre de molécules sans eau est la même, et par conséquent, ils ne transféreront pas la barrière semi-perméable n'importe où dans le but de faire correspondre les concentrations des ions.
préparation
- Conditions et équation
Bien qu'une solution isotonique puisse être préparée avec n'importe quel solvant, car l'eau est le milieu des cellules, cela est considéré comme l'option préférée. Connaissant exactement la concentration de sels dans un corps spécifique du corps, ou dans la circulation sanguine, il est possible d'estimer la quantité de sels à dissoudre dans un volume donné.
Dans les organismes vertébrés, il est admis qu'en moyenne, la concentration des solutés dans le plasma sanguin est d'environ 300 mOsm / L (miliosmolarité), étant capable d'interpréter presque comme 300 mmol / L. C'est-à-dire, c'est une concentration très diluée. Pour estimer la miliosmolarité, l'équation suivante doit être appliquée:
Osmolarité = m · v · g
À des fins pratiques, il est supposé que g, Le coefficient osmotique, a une valeur de 1. De sorte que l'équation est maintenant comme:
Osmolarité = m · v
Où m C'est la molarité du soluté, et V Le nombre de particules dans lesquelles ledit soluté se dissocie dans l'eau. Ensuite, nous multiplions cette valeur par 1.000 pour obtenir la miliosmolarité pour un soluté particulier.
Peut vous servir: qu'est-ce que l'homoplasie? (Avec des exemples)S'il y a plus d'un soluté, la miliosolarité totale de la solution sera la somme des milliers de molarités pour chaque soluté. Plus il y a de soluté par rapport à l'intérieur des cellules, moins la solution préparée sera la solution préparée.
- Exemple de préparation
Supposons que vous souhaitiez préparer un litre d'une solution isotonique basée sur le glucose et le phosphate de diácide de sodium. Combien devrait être peser le glucose? Supposons que 15 grammes de non seront utilisés2Pote4.
Premier pas
Nous devons d'abord déterminer l'osmolarité nah2Pote4 Calcul de sa molarité. Pour ce faire, nous nous tournons vers sa masse molaire ou son poids moléculaire, 120 g / mol. Parce que on nous demande un litre de solution, nous déterminons les taupes et nous aurons directement la molarité:
Graphiques (non2Pote4) = 15 g ÷ 120g / mol
= 0,125 mol
M (non2Pote4) = 0,125 mol / L
Mais quand le Nah2Pote4 Il se dissout dans l'eau, libère un na cation+ et un anion h2Pote4-, Pour ce que V Il a une valeur de 2 dans l'équation d'osmolarité. Nous procédons à calculer alors pour le Nah2Pote4:
Osmolarité = m · v
= 0,125 mol / L · 2
= 0,25 OSM / L
Et en le multipliant par 1.000 Nous avons la miliosmolarité de NAH2Pote4:
0,25 OSM / L · 1.000 = 250 MOSM / L
Deuxième pas
Comme la miliosolarité totale de la solution doit être égale à 300 MOSM / L, nous soustrayons pour savoir ce que devrait être le glucose:
MOSM / L (glucose) = MOSM / L (TOTAL) - MOSM / L (NAH2Pote4)
= 300 MOSM / L - 250 MOSM / L
= 50 MOSM / L
Parce que le glucose ne se dissocie pas, V Vale 1 et son osmolarité sont égaux à sa molarité:
M (glucose) = 50 mosm / l ÷ 1.000
= 0,05 mol / L
Étant la molaire du glucose 180 g / mol, nous déterminons enfin combien de grammes nous devons peser pour le dissoudre dans ce litre de solution isotonique:
Peut vous servir: Renina: structure, production, sécrétion, fonctionsMasse (glucose) = 0,05 mol · 180 g / mol
= 9 g
Par conséquent, cette solution isotonique nah2Pote4/ Le glucose prépare 15 grammes de non2Pote4 et 9 grammes de glucose dans un litre d'eau.
Exemples de solutions isotoniques
Les solutions ou liquides isotoniques ne provoquent aucun gradient ni changement dans la concentration d'ions dans le corps, leur action se concentre donc essentiellement sur les patients hydratants qui le reçoivent en cas de saignement ou de déshydratation.
Solution saline normale
L'une de ces solutions est une solution saline normale, avec une concentration de NaCl à 0,9%.
Solution de lactate de la sonnerie
Les autres solutions isotoniques utilisées dans le même but sont celles du lactate de Ringer, qui diminue l'acidité due à sa composition tampon ou à l'amortissement, et les solutions de phosphate de Sorensen, qui sont composées de phosphates et de chlorure de sodium.
Systèmes non aqueux
L'isotonie peut également être appliquée à des systèmes non aqueux, tels que ceux où le solvant est un alcool; Tant, il existe une barrière semi-perméable qui favorise la transparence des molécules d'alcool et conserve les particules de soluté.
Les références
- De Lehr Spilva, à. Et muktans, et. (1999). Guide des spécialités pharmaceutiques au Venezuela. Édition xxxvª. Éditions mondiales.
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Elsevier B.V. (2020). SOLUTION ISOTONIQUE. Récupéré de: ScienceDirect.com
- Brundage Adrienne. (2020). Solution isotonique: définition et exemple. Étude. Récupéré de: étudier.com
- Felicitas Merino de la Hoz. (s.F.). Sérothérapie intraveineuse. Université de Cantabrie. [PDF]. Récupéré de: OCW.Monnaie.est
- Le laboratoire de pharmaceutique et de composition. (2020). Préparations ophtalmiques: tampons isotoniques. Récupéré de: pharmlabs.UNC.Édu
- « Les 15 caractéristiques du théâtre les plus importantes
- Caractéristiques, utilisations et exemples de parallélisme »

