Solution insaturée
- 4269
- 797
- Noa Da silva
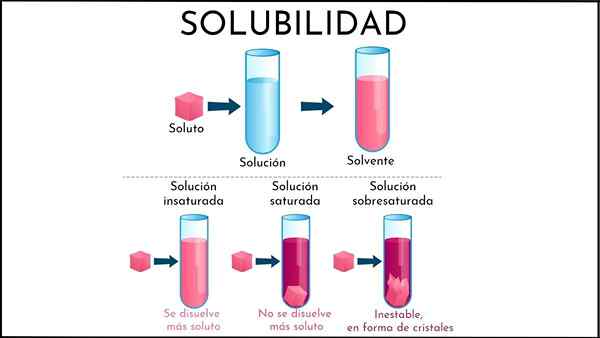
 Dans la solution insaturée, la moitié du solvant est toujours capable de dissoudre plus de soluté
Dans la solution insaturée, la moitié du solvant est toujours capable de dissoudre plus de soluté Qu'est-ce qu'une solution insaturée?
Ongle solution insaturée C'est toute cette solution dans laquelle le milieu de solvant est toujours capable de dissoudre plus de soluté. Ce milieu est généralement liquide, bien qu'il puisse également être gazeux. En ce qui concerne le soluté, c'est un conglomérat de particules solides ou gazeuses.
Et qu'en est-il des solutés liquides? Dans ce cas, la solution est homogène tant que les deux liquides sont miscibles. Un exemple de cela est l'ajout d'alcool éthylique à l'eau; Les deux liquides avec leurs molécules, Cho3Ch2Oh et h2Ou, ils sont miscibles parce qu'ils forment des ponts d'hydrogène (choisissez3Ch2Oh oh2).
Cependant, si le diclorométhane se mélange (choisissez2CL2) et l'eau, celles-ci formeraient une solution avec deux phases: l'une aqueuse et l'autre organique. C'est parce que les choles de ch2CL2 et h2Ou interagir très faiblement, donc certains glissent sur les autres, résultant en deux liquides non miscibles.
Une goutte minimale de Cho2CL2 (Soluté) suffisant pour saturer l'eau (solvant). Si, au contraire, ils pourraient former une solution insaturée, une solution complètement homogène serait vue.
Pour cette raison, seuls les solutés solides et gazeux peuvent générer des solutions insaturées.
Qu'est-ce qu'une solution insaturée?
Dans une solution insaturée, les molécules de solvant interagissent avec l'efficacité de telle sorte que les molécules de soluté ne peuvent pas former une autre phase.
Cela signifie que les interactions solue au solvant dépassent, compte tenu des conditions de pression et de température, les interactions soluté-solue.
Une fois que les interactions soluté-solue augmentent, ils "orchestrent" la formation d'une deuxième phase. Par exemple, si le milieu de solvant est un liquide et le soluté un solide, le second se dissoudra dans le premier pour former une solution homogène, jusqu'à ce qu'une phase solide apparaisse, ce qui n'est rien de plus que le soluté précipité.
Il peut vous servir: polyméthylmétacrylateCe précipité est dû au fait que les molécules de soluté parviennent à être regroupées par leur nature chimique, intrinsèque à leur structure ou à leurs liens. Lorsque cela se produit, on dit que la solution est saturée de soluté.
Par conséquent, une solution de soluté insaturée se compose d'une phase liquide sans précipité. Alors que si le soluté est gazeux, alors une solution insaturée doit être exempte de la présence de bulles (qui ne sont rien de plus que des grappes de boissons gazeuses).
Effet de température
La température influence directement le degré d'insaturation d'une solution par rapport à un soluté.
Cela peut être principalement dû à deux raisons: l'affaiblissement des interactions soluté-solute dues à l'effet thermique et l'augmentation des vibrations moléculaires qui aident à disperser les molécules de soluté.
Si un milieu de solvant est considéré comme un espace compact dans les trous duquel les molécules de soluté sont logées, la température augmente les molécules vibrer la taille de ces trous; De telle manière que le soluté peut faire son chemin dans d'autres directions.
Solides insolubles
Cependant, certains solutés ont des interactions aussi fortes, que les molécules de solvant sont à peine capables de les séparer.
Quand il en est ainsi, une concentration minimale dudit soluté dissous est suffisante pour qu'il précipite, puis c'est un solide insoluble.
Les solides insolubles, en formant une deuxième phase solide qui diffère de la phase liquide, génèrent peu de solutions insaturées.
Par exemple, si 1L du liquide A ne peut dissoudre que 1 g de B sans précipiter, alors lors du mélange 1L de A avec 0.5 g de B générera une solution insaturée.
Il peut vous servir: hydrocoloïdeDe même, un rang de concentrations allant entre 0 et 1 g de B forment également des solutions insaturées. Mais après 1g, B précipitera. Lorsque cela se produit, la solution passe de insaturée à saturée de b.
Si une solution saturée avec 1 est soumise au chauffage.5g de b, la chaleur aidera la dissolution du précipité. Cependant, s'il y a beaucoup de b précipité, la chaleur ne peut pas la dissoudre.
Dans l'affirmative, une augmentation de la température évaporerait simplement le solvant ou le liquide à.
Exemples de solution insaturée
Les exemples de solutions insaturées sont nombreuses, car elles dépendent du solvant et du soluté. Par exemple, pour le même liquide A et d'autres solutés C, D, E… Z, leurs solutions seront insaturées tant qu'elles ne précipitent pas ou ne forment pas une bulle (si ce sont des solutés gazeux).
-La mer peut apporter deux exemples. L'eau de mer est une solution de récupération massive. Si vous placez pour bouillir un peu de cette eau, il sera noté qu'il n'est pas saturé en l'absence de sel précipité. Cependant, à mesure que l'eau s'évapore, les ions dissous commencent à être regroupés, laissant le salpoir collé au pot.
-Un autre exemple est la dissolution de l'oxygène dans l'eau des mers. La molécule de o2 Frank les profondeurs de la mer pour respirer la faune marine, bien qu'elle soit peu soluble.
Pour cette raison, il est courant d'observer les bulles d'oxygène émergeant à la surface; dont quelques molécules parviennent à se dissoudre.
Une situation similaire se produit avec la molécule de dioxyde de carbone, CO2. Contrairement à O2, Le CO2 Il est légèrement plus soluble car il réagit avec l'eau pour former l'acide carbonique, H2CO3.
Peut vous servir: systèmes de matériauxDifférence avec une solution saturée
Résumant la nouvelle explication, quelles sont les différences entre une solution insaturée et saturée? Premièrement, l'aspect visuel: une solution insaturée se compose d'une seule phase. Par conséquent, il ne devrait pas y avoir de présence de solide (phase solide) ou de bulle (phase de soude).
De plus, les concentrations de soluté dans une solution insaturée peuvent varier jusqu'à ce qu'un précipité ou une bulle se forme. Alors que dans des solutions biphasiques saturées (liquide-solide ou liquide-gazeux), la concentration de soluté dissous est constante.
Parce que? Parce que les particules (molécules ou ions) qui composent le précipité établissent un équilibre avec ceux qui se dissolvent dans le solvant:
Particules du précipité dissous des particules
Molécules de bulle dissous des molécules
Ce scénario n'est pas envisagé dans des solutions insaturées. Lorsque vous essayez de dissoudre plus de soluté dans une solution saturée, l'équilibre se déplace vers la gauche; à la formation de plus de précipités ou de bulles.
Parce que dans les solutions insaturées, cet équilibre (saturation) n'a pas encore été établi (saturation) peut "stocker" plus solide ou gaz.
Autour d'une algue dans le fond marin, il y a de l'oxygène dissous, mais lorsque des bulles d'oxygène naissent de ses feuilles, cela signifie que la saturation des gaz se produit; Sinon, les bulles ne seraient pas observées.
Les références
- Chimie générale. Matériel d'apprentissage. Lima: Université pontificale catholique du Pérou. Récupéré de: Corinthe.PUCP.Édu.pe
- Helmestine, Anne Marie, Ph.D. (2018). Définition de la solution insaturée. Récupéré de: Thoughtco.com
- Tutorvista (s.F.). Solution insaturée. Tiré de: chimie.Tutorvista.com
- Chimie Libretsexts (S.F.). Types de saturation. Récupéré de: Chem.Bibliothèque.org
- Nadine James. (2018). Solution insaturée: définition et exemple. Récupéré de: étudier.com

