Structure cristalline des solides, propriétés, types, exemples

- 3965
- 298
- Noa Da silva
Les solides cristallins Ce sont ceux dont les structures microscopiques sont commandées et obéissent à un modèle distinctif pour un certain réseau cristallin; Par exemple: cube, hexagonal, triclinique, rhomboédrica, entre autres.
On dit que ces solides existent sous forme de cristaux, qui montrent des facettes et des conceptions géométriques qui reflètent la façon dont l'ordre est à l'intérieur. Les autres exemples de solides cristallins sont le diamant, le quartz, l'anthracène, la glace sèche, le chlorure de potassium ou l'oxyde de magnésium.
 Une barre cristalline du crime. Source: Pixabay.
Une barre cristalline du crime. Source: Pixabay. Une paire de solides cristallins très connus est celui du sucre et du sel (NaCl). À première vue, les deux portent des cristaux blancs; Mais ses propriétés diffèrent considérablement. Le sucre est un solide cristallin moléculaire, tandis que le sel est un solide cristallin ionique. Le premier est composé de molécules de saccharose; Et le second, des ions na+ et cl-.
L'image supérieure vous permet d'apercevoir à quel point les cristaux de sucre brillants peuvent être. Cristaux de sel mais ils ne sont pas loin derrière. Bien que le sucre et le sel ressemblent à des frères, leurs structures sont différentes: le sucre, qui devient du saccharose, a une structure monoclinique; Pendant que le sel, une structure cubique.
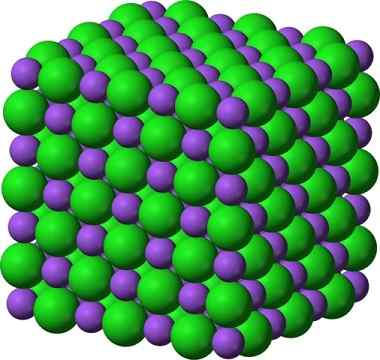 Structure cristalline du chlorure de sodium, NaCl
Structure cristalline du chlorure de sodium, NaCl Le sucre pulvérisé et le sel (GLAS) restent cristallins; Ses cristaux ne sont devenus beaucoup plus petits que pour nos yeux. La cristallinité d'un solide est donc définie davantage par sa structure interne que par son apparence externe ou ses paillettes.
[TOC]
Structure des solides cristallins
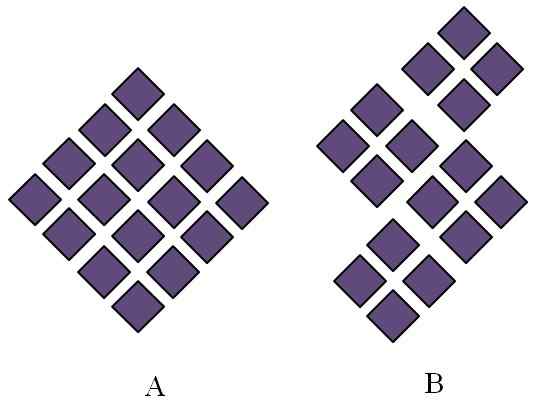 Structures ordonnées de solides cristallins. Source: Gabriel Bolívar.
Structures ordonnées de solides cristallins. Source: Gabriel Bolívar. Les solides cristallins ont commandé des structures. Ses caractéristiques géométriques dépendront du type de réseau cristallin auquel ils appartiennent, qui à son tour est projeté à l'extérieur sous les formes du cristal (système cristallin). L'image supérieure illustre deux concepts importants de telles structures: la périodicité et les grains cristallins.
Peut vous servir: phase de dispersionLe système spatial des particules d'un solide cristallin est un journal; c'est-à-dire qu'il est répété encore et encore dans toutes les directions. Cela provoque son propre schéma structurel pour chaque réseau solide et cristallin; Par exemple, c'est là que le sel et le sucre commencent à se différencier au-delà de sa nature chimique.
Dans les rhombes, ils sont ordonnés de donner naissance à un losange de plus grandes proportions. Chaque rhombus violet représente une particule ou un ensemble d'entre elles (atomes, ions ou molécules). Ainsi, on pourrait s'attendre à ce qu'un cristal macroscopique de A ait une apparence Rhomboédica.
Pendant ce temps, en B, les rhombes sont ordonnées de telle manière qu'elles proviennent des grains cristallins; Ce sont, de très petits cristaux (cristallites). On dit alors que B est un solide polyristal; c'est-à-dire qu'il est formé par l'agglomération multiple cristallite.
En conclusion, un solide peut être simplement cristallin (a) ou polyristaline (b); Sous forme de cristaux, tandis que B Polyristales.
Propriétés
Les propriétés des solides cristallins dépendent de son type de verre. On sait que leurs structures sont commandées et qu'ils présentent également généralement des factions brillantes qui tombent amoureuses des amateurs de minéraux. Cependant, il a été mentionné qu'un solide poussiéreux, y compris "off", peut également être classé comme cristallin.
La façon dont leurs particules sont orientées spatialement leur permet d'avoir des propriétés importantes pour leur caractérisation. Par exemple, les solides cristallins sont capables de diffracter les rayons X, créant des spectres de diffraction à partir desquels la structure microscopique d'un cristal peut être déterminée.
De même, parce que la structure est périodique, la chaleur est diffusée de la même manière tout au long du solide; tant qu'il n'y a pas d'impuretés entre les deux. Ainsi, les points de fusion pour un solide cristallin sont constants et ne varient pas quelle que soit la façon dont ils sont mesurés.
Il peut vous servir: Gallium: propriétés, structure, obtention, utilisationsTypes de solides cristallins
Les types de solides cristallins sont basés sur le type de particules le composent et quelles sont leurs interactions ou liens. Il existe quatre types: réseaux ioniques, métalliques, moléculaires et covalents.
Même lorsqu'ils présentent un certain degré d'impuretés, ils continuent d'être cristallins, bien que leurs propriétés soient affectées et ne montrent pas les mêmes valeurs attendues pour un solide pur.
Ionique
Le sel est un exemple de solide cristallin ionique, car il est composé d'ions nas+ et cl-. Par conséquent, dans ce type de solides, l'obligation ionique gouverne: ce sont les forces électrostatiques qui régissent l'ordre structurel.
Métal
Tous les atomes métalliques forment des cristaux métalliques. Cela signifie que, par exemple, une fourche en argent est un conglomérat de cristaux d'argent fusionnés. La structure interne ou microscopique est la même dans chaque paume de l'objet et reste inchangée de la poignée de la fourche vers la pointe de ses dents.
Moléculaire
Le sucre est un exemple de solide cristallin moléculaire, car il est formé de molécules de saccharose. Par conséquent, ce type de solide se compose de molécules qui, à travers ses interactions intermoléculaires (et liaisons non covalentes), parviennent à établir une structure ordonnée.
Réseaux covalents
Enfin, nous avons les solides cristallins des réseaux covalents. Ils prédominent les liaisons covalentes, car ils sont responsables de l'établissement d'une commande et du maintien des atomes fortement fixés dans leurs positions d'espace respectives. On ne parle pas d'ions, d'atomes ou de molécules, mais de réseaux à trois dimensions.
Exemples
Ensuite, et enfin, quelques exemples seront cités pour chacun des types de solides cristallins.
Peut vous servir: électronégativitéIonique
Tous les sels sont des solides ioniques. Il existe également des sulfures, des hydroxydes, des oxydes, des halogénures et d'autres composés qui sont également formés par des ions, ou leurs interactions sont en essence ionique. Nous avons:
-KCl
-Cas4
-Ba (oh)2
-Cuso4
-Fecl3
-N / A2S
-Mgo
-Caf2
-Nahco3
-(NH4)2Cro4
En plus de ces exemples, la grande majorité des minéraux sont considérés comme des solides cristallins ioniques.
Métal
Tout élément métallique est naturellement présenté sous forme de cristaux métalliques. Certains d'entre eux sont:
-Cuivre
-Fer
-Aluminium
-Chrome
-Hydrogène métallique (sous des pressions inimaginables)
-Tungstène
-Zirconium
-Titane
-Magnésium
-Sodium
Moléculaire
Il existe une grande variété de solides cristallins moléculaires. Pratiquement tous les composés organiques qui se solidifie parviennent à établir des cristaux si sa pureté est élevée, ou si sa structure n'est pas trop complexe. Donc nous avons:
-Glace (h2SOIT)
-Glace sèche (CO2)
-Toi2
-P4
-S8 (et ses polymorphes)
-Anthracène
-Oxygène solide
-Ammoniac solide
-Phénolphthaleine
-Acide benzoique
Réseaux covalents
Et enfin, parmi certains solides cristallins de réseaux covalents que nous avons:
-diamant
-Graphite
-Nanotubes de carbone
-Fullerrenos
-Quartz
-Silicium
-Germanium
-Nitrure de bore
De cette liste, les nanotubes de carbone et Fullerène pourraient également être considérés comme des solides cristallins moléculaires. En effet, bien qu'ils se composent d'atomes de carbones unis covalents, ils définissent des unités qui peuvent être visualisées sous forme de macromolécules (balles de football et tubes).
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2020). Cristal. Récupéré de: dans.Wikipédia.org
- CHIMISTER BOOLISTexts. (16 juin 2019). Solides cristallins et amorphes. Récupéré de: Chem.Bibliothèque.org
- Rachel Bernstein et Anthony Carpi. (2020). Propriétés des solides. Récupéré de: VisionLearning.com
- « Structure des solides amorphes, propriétés, exemples
- Causes démographiques, conséquences, avantages, inconvénients »

