Structure des solides amorphes, propriétés, exemples

- 1812
- 39
- Justine Charpentier
Les solides amorphes Ce sont ceux qui n'ont pas de structure à long terme ordonnée. Ils sont l'opposé de ce qui est connu par un solide cristallin. Leurs particules sont associées de manière désordonnée, similaire à celle des liquides, mais avec une force suffisante pour la cohésion dans une structure solide.
Ce caractère amorphe est plus courant qu'on ne pourrait le penser; C'est en fait l'un des États possibles que la matière condensée peut adopter. Cela comprend que tout composé capable de se solidifier et, par conséquent, de cristallisation, peut également être attaché de manière désordonnée si les conditions expérimentales le permettent.
 Le coton de sucre est un exemple de solide amorphe. Source: Pixabay.
Le coton de sucre est un exemple de solide amorphe. Source: Pixabay. Ce qui précède est généralement appliqué aux substances pures, que ce soit des éléments ou des composés. Mais il est également valable dans le cas des mélanges. De nombreux mélanges solides sont amorphes, comme avec du coton de sucre, de chocolat, de mayonnaise ou de purée de pommes de terre.
Celui qu'un solide est amorphe ne le rend pas moins précieux qu'un cristallin. Le trouble structurel lui donne parfois des propriétés uniques qui ne se présenteraient pas dans un état cristallin. Par exemple, le silicium amorphe est préféré dans l'industrie photovoltaïque avant l'objectif pour certaines petites applications à l'échelle.
[TOC]
Structure des solides amorphes
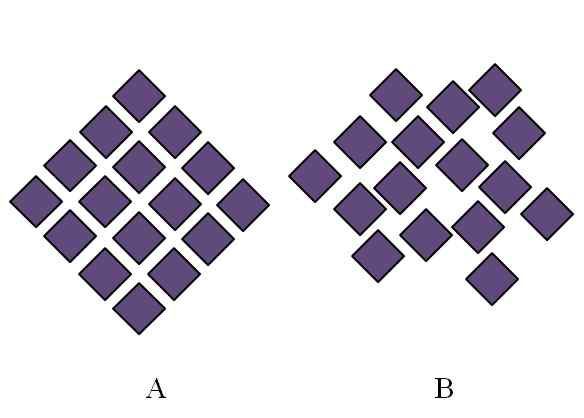 Différence entre une structure cristalline et une structure amorphe. Source: Gabriel Bolívar.
Différence entre une structure cristalline et une structure amorphe. Source: Gabriel Bolívar. La structure d'un solide amorphe est désordonnée; Il manque de périodicité ou d'un modèle structurel. L'image supérieure illustre ce point. Il correspond à un solide cristallin, tandis que B représente un solide amorphe. Notez que dans B Purple Rhombus est arbitairement organisé, même lorsque les deux et B, il y a le même type d'interactions.
Peut vous servir: Phénolphthalein (C20H14O4)Si B est également vu, on verra qu'il existe des espaces qui semblent être vides; c'est-à-dire que la structure présente des défauts ou des irrégularités. Par conséquent, une partie du trouble microscopique ou interne d'un solide amorphe est due au fait que ses particules "s'adaptent" à une manière de telle manière que la structure résultante a de nombreuses imperfections.
Au début, la portée a été faite dans le degré d'ordre des solides amorphes. En b, il n'y a pratiquement pas quelques rhombes qui semblent alignées dans l'ordre. Il peut y avoir des régions ordonnées; Mais seulement dans la courte portée.
On dit ensuite qu'un solide amorphe est fait de cristaux incommensurables minuscules de différentes structures. La somme de toutes ces structures finit par labyrinthique et dénuée de sens: la structure globale devient amorphe, composée d'une multitude de blocs cristallins dispersés partout.
Propriétés
Les propriétés d'un solide amorphe varient en fonction de la nature de ses particules conformes. Cependant, certaines caractéristiques générales peuvent être mentionnées. Les solides amorphes peuvent être vitreux lorsqu'ils ont des aspects similaires aux cristaux; ou geléeneux, résineux ou poussiéreux.
Être leurs structures désordonnées ne génèrent pas des spectres de diffraction des rayons x fiables. De plus, ses points de fusion ne sont pas précis, mais couvrent un intervalle de valeurs.
Par exemple, le point de fusion pour un solide amorphe peut varier de 20 à 60 ºC. Pendant ce temps, les solides cristallins fondent à une température spécifique, ou dans un intervalle étroit s'ils contiennent de nombreuses impuretés.
Une autre caractéristique des solides amorphes est que lorsqu'ils se cassent ou se fracturent, ils ne provoquent pas de faces géométriques et plates, mais des fragments irréguliers avec des visages incurvés. Quand ils ne sont pas vitreux, ils sont présentés comme des corps poussiéreux et opaques.
Il peut vous servir: Alilo: unité allyique, carbocation, radical, exemplespréparation
Plus qu'un solide amorphe, il est pratique de traiter ce concept comme un «état amorphe». Tous les composés (ioniques, moléculaires, polymères, métalliques, etc.) Ils sont capables, dans une certaine mesure, et si les conditions expérimentales le permettent, de former des solides amorphes et non cristallins.
Par exemple, dans la synthèse organique, les composés solides au début sont obtenus sous forme de masses poussiéreuses. Sa teneur en impuretés est si élevée que celles-ci affectent son ordre moléculaire à long terme. C'est pourquoi lorsque le produit est recripté encore et encore, le solide devient de plus en plus cristallin; Perd son caractère amorphe.
Cela ne signifie pas que les solides amorphes sont nécessairement des matériaux impurs; Plusieurs d'entre eux sont amorphes pour leur propre nature chimique.
Une substance pure peut se solidifier amorphiquement si votre liquide se refroidit brusquement, afin que leurs particules ne se cristallisent pas, mais adoptent une configuration vitreuse. Le refroidissement est si rapide que les particules n'ont pas assez de temps pour accueillir les blocs cristallins qui sont à peine "nés".
L'eau, par exemple, est capable d'exister dans un état vitreux, amorphe et pas seulement comme la glace.
Exemples de solides amorphes
Minéraux et plastique
 L'obsidienne est l'un des rares minéraux amorphes connus. Source: Pixabay.
L'obsidienne est l'un des rares minéraux amorphes connus. Source: Pixabay. Pratiquement tous les matériaux cristallins peuvent s'adapter à une forme amorphe (et vice versa). Cela se produit avec certains minéraux qui, pour des raisons géochimiques, ne pouvaient pas formellement établir leurs cristaux conventionnels. D'autres, en revanche, ne forment pas de cristaux mais du verre; C'est le cas de l'obsidienne.
D'un autre côté, les polymères ont tendance à se solidifier amorphiquement, car leurs molécules sont trop grandes pour définir une structure ordonnée. Voici des résines, des caoutchoucs, de la mousse de polystyrène (anime), des plastiques, du téflon, de la baquelita, entre autres.
Peut vous servir: estersTissu biologique
Les solides biologiques sont principalement amorphes, comme: tissu organique, peau, cheveux, cornée, etc. De plus, les graisses et les protéines forment des masses amorphes; Cependant, avec une préparation adéquate, ils peuvent cristalliser (cristaux d'ADN, protéines, graisses).
Verre
 Verre, un solide amorphe
Verre, un solide amorphe Bien que presque en dernier, le solide amorphe le plus représentatif est de loin le verre lui-même. Sa composition est en substance la même que celle du quartz: sio2. Le cristal de quartz et le verre sont des réseaux covalents à trois dimensions; Seul le réseau de verre est désordonné, avec des liens SI ou des longueurs différentes.
 Échantillon de verre métallique
Échantillon de verre métallique Le verre est la solide par excellence amorphe, et les matériaux qui acquièrent une apparence similaire auraient un état vitreux.
Carbone et métaux
Nous avons du carbone amorphe, étant le carbone activé l'un des plus importants pour ses capacités absorbantes. Il y a aussi le silicium et l'Allemagne amorphes, avec des applications électroniques où ils agissent comme des semi-conducteurs.
Et enfin, il y a des alliages amorphes, qu'en raison de la disparité de leurs atomes métalliques conformes, ils n'établissent pas de structure cristalline.
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Rachel Bernstein et Anthony Carpi. (2020). Propriétés des solides. Récupéré de: VisionLearning.com
- Wikipédia. (2020). Solide amorphe. Récupéré de: dans.Wikipédia.org
- Richard Zallen, Ronald Walter Douglas et autres. (31 juillet 2019). Solide amorphe. Encyclopædia Britannica. Récupéré de: Britannica.com
- Elsevier B.V. (2020). Solide amorphe. ScienceDirect. Récupéré de: ScienceDirect.com
- Danielle Reid. (2020). Solide amorphe: définition et exemple. Étude. Récupéré de: étudier.com
- Les œuvres d'art du cube de Rubik. (2008). Qu'est-ce qu'un matériau amorphe? Récupéré de: Web.La physique.UCSB.Édu
- « Concept de rôle social selon Talcott Parsons, types et exemples
- Structure cristalline des solides, propriétés, types, exemples »

