Propriétés du système thermodynamique, types, exemples
- 4014
- 273
- Raphaël Charles
UN Système thermodynamique o La substance de travail fait partie de l'univers qui est choisi pour être étudié par thermodynamique. C'est une définition très large, car un système thermodynamique peut être vaste comme une galaxie ou c'est une petite quantité de gaz contenu dans un cylindre.
Tout ce qui entoure le système thermodynamique, y compris la masse et l'espace, est l'environnement ou l'environnement de la même. Ce n'est pas le reste de l'univers, mais seulement l'environnement capable d'affecter le système.
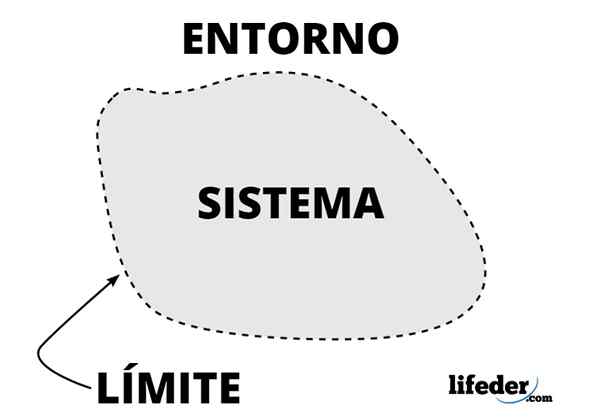
 Schéma d'un système thermodynamique
Schéma d'un système thermodynamique Dans un système thermodynamique, l'échange de masse ou d'énergie est possible entre le système et l'environnement, selon la classe du système, étant l'environnement où les observateurs qui l'étudient sont situés.
Dans l'analyse d'un système thermodynamique, il est important d'établir le les frontières (limites ou murs), qui peuvent être fixes ou mobiles. Une bouteille en verre ou en métal a des murs fixes, mais un piston ou un piston mobile.
En tant que tel, la frontière peut être une surface réelle ou imaginaire, mais idéalement elle a une épaisseur nulle, une certaine rigidité et d'autres caractéristiques décrites sous forme mathématique.
Des frontières imaginaires sont nécessaires lors de l'étude des systèmes qui à leur tour font partie de systèmes beaucoup plus grands, comme une étoile dans une nébuleuse.
Les échanges de chaleur entre le système et son environnement, le cas échéant, sont les principaux objectifs de la thermodynamique. C'est pourquoi un nom spécial est donné aux murs qui permettent l'échange: adiabatique, tandis que ceux qui ne le permettent pas et ne l'isolent pas sont diathermiques.
[TOC]
Types de systèmes thermodynamiques
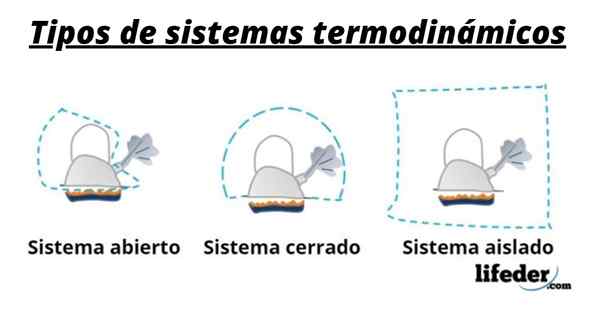 Dans le premier cas, c'est un système ouvert car la théière échange l'énergie libérée par le feu et le gaz sous la forme d'un gaz à l'extérieur. Dans le deuxième cas, c'est un système fermé car je n'échange de l'énergie libérée que par l'incendie, mais pas le gaz. Le troisième cas est un système isolé car il n'échange pas d'énergie ni de compte.
Dans le premier cas, c'est un système ouvert car la théière échange l'énergie libérée par le feu et le gaz sous la forme d'un gaz à l'extérieur. Dans le deuxième cas, c'est un système fermé car je n'échange de l'énergie libérée que par l'incendie, mais pas le gaz. Le troisième cas est un système isolé car il n'échange pas d'énergie ni de compte. Il existe différents types de systèmes thermodynamiques, qui sont classés en fonction de leur capacité à échanger de la matière et de l'énergie avec l'environnement, de cette manière, nous avons:
Systèmes ouverts
L'échange de matière et d'énergie avec l'extérieur est autorisé, donc ils sont également appelés Volume de contrôle.
Un grand nombre de systèmes d'ingénierie sont modélisés de cette manière, par exemple le chauffe-eau et les radiateurs de voitures faits maison.
Peut vous servir: 21 événements importants de la physiqueSystèmes fermés
Ils sont également connus sous le nom de masse de contrôle et sont caractérisés car il n'y a pas d'échange de matière avec l'environnement. Par conséquent, sa masse est fixe, mais l'énergie peut franchir sa limite, soit en chaleur ou en travail. De cette façon, le volume du système peut varier.
Systèmes isolés
Ce sont des systèmes fermés dans lesquels l'échange de chaleur, de travail ou de toute forme d'énergie avec l'environnement est empêché.
Systèmes homogènes et systèmes hétérogènes
Les systèmes décrits ont été classés en fonction de leur capacité d'échange avec l'environnement, mais ce n'est pas le seul critère. Les systèmes thermodynamiques peuvent également être homogènes et hétérogènes.
Les substances pures sont de bons exemples de systèmes homogènes, tels que le sel de table sauvé dans le salin shaker. Au contraire, une combinaison d'eau liquide et de vapeur d'eau est un système hétérogène, car ce sont deux états différents, dont les propriétés diffèrent.
Exemples de systèmes thermodynamiques
Comme nous l'avons vu, les systèmes thermodynamiques sont des plus simples au plus complexes. Cependant, lorsque vous les étudiez, il est pratique de les définir attentivement et d'essayer de trouver toutes les façons pour simplifier l'analyse.
Regardons quelques exemples de systèmes réels qui nous accompagnent dans la vie quotidienne:
Récipient immergé dans l'eau

Il s'agit d'un système thermodynamique très simple et illustratif, et aussi un bon moyen de préparer la nourriture. Le contenu du récipient, que ce soit des œufs, un mélange pour un flan ou la préparation, est le système thermodynamique, tandis que le bain-marie constitue l'environnement ou l'environnement ou l'environnement.
Peut vous servir: quel est le moment magnétique?Lors du chauffage de l'eau, la chaleur s'écoule vers le système à travers la bordure du récipient.
La vitesse à laquelle la nourriture est cuite dépend de plusieurs facteurs, l'un d'eux est le matériau de la casserole: s'il s'agit de céramique ou de métal. Nous savons que le métal est un bon chauffeur de chaleur, nous espérons donc que le contenu se réchaufferait rapidement si un récipient en acier ou en aluminium est utilisé.
Au lieu de chauffer le système, vous voulez. Dans ce cas, le système donne de la chaleur au bain-marie.
Cuire dans une casserole à découvert
 Le poulet et le pain cuit dans une casserole ouverte sont un exemple de système thermodynamique ouvert. Source: Pixabay.
Le poulet et le pain cuit dans une casserole ouverte sont un exemple de système thermodynamique ouvert. Source: Pixabay. La cuisine est un excellent endroit pour trouver des processus thermodynamiques. Une sauce, un poulet ou d'autres aliments cuits dans une casserole ouverte, est un exemple de système ouvert, car tous les types d'échange avec l'environnement sont autorisés: ajouter des condiments, d'autres ingrédients et modifier la chaleur ajoutée.
Moteur à combustion interne
Dans le moteur à combustion interne des voitures, des motos, des avions et des bateaux, il y a un mélange de gaz (air) et de carburant préparé dans le carburateur et est emmené au cylindre, où par l'effet de la combustion, il devient un mélange de gaz plusieurs.
Comme la composition du mélange varie tout au long du cycle de travail, c'est un système thermodynamique complexe et hétérogène.
Café ou thé dans un thermos
 La boisson chaude ou froide à l'intérieur d'un thermos est un bon exemple de système thermodynamique fermé. Source: Pixabay.
La boisson chaude ou froide à l'intérieur d'un thermos est un bon exemple de système thermodynamique fermé. Source: Pixabay. Le café ou le thé restent chauds plus longtemps dans un thermos. Il s'agit d'un récipient fourni de murs isolants, précisément pour empêcher notre système - boisson chaude - livrer sa chaleur à l'environnement et refroidir.
Peut vous servir: Volt ou Volt: concept et formules, équivalences, exemplesUn thermos est vraiment deux conteneurs, parmi lesquels il est partiel vide pour éviter la présence d'un milieu de l'air, ce qui aide à faire passer la chaleur de l'intérieur vers le récipient.
Bien sûr, le thermos fonctionne également inversé, sert à garder les boissons froides plus longtemps.
Œufs
Les œufs que nous consommons en tant que nourriture sont d'excellents exemples de systèmes thermodynamiques fermés, mais qui permettent un échange d'énergie avec l'environnement. La peau d'oeuf laisse la chaleur des galles Empol l'embryon, ainsi que le passage des gaz.
Cellules
La cellule est l'unité fondamentale des êtres vivants et est un système thermodynamique merveilleusement efficace. Par extension, tout être vivant peut également être considéré comme un système thermodynamique complexe.
La membrane cellulaire qui couvre les structures internes telles que le noyau et les mitochondries est la frontière entre le système et l'environnement. Cela permet l'échange d'énergie, l'arrivée des nutriments de l'extérieur et la production de déchets.
En conserve
Les repas en conserve sont des exemples typiques de systèmes thermodynamiques fermés.
Chauffe-eau
L'eau à l'intérieur du radiateur est un système thermodynamique ouvert, car c'est le gaz nécessaire.
Les références
- Borgnakke. 2009. Fondamentaux de la thermodynamique. 7e édition. Wiley et fils.
- Cengel, et. 2012. Thermodynamique. 7e édition. McGraw Hill.
- Énergie solaire. Systèmes thermodynamiques. Récupéré de: Solar-Anergy.filet.
- Wikipédia. Systèmes thermodynamiques. Récupéré de: est.Wikipédia.org.
- Wikipédia. Système thémodynamique. Récupéré de.Wikipédia.org.
- « Coûts de production Éléments, types, comment calcule, exemples
- Attaque nucléophile nucléophile, types, exemples, nucléophilicité »

