Saponification

- 1749
- 387
- Prof Ines Gaillard
Nous expliquons ce qu'est Sponification, sa réaction, pourquoi elle est importante et donne plusieurs exemples
 Des savons artisanaux préparés par saponification
Des savons artisanaux préparés par saponification Qu'est-ce que la saponification?
La saponification C'est le processus chimique par lequel le savon est fait. En fait, la saponification signifie littéralement la fabrication du savon. Ce processus se compose d'hydrolyse alcaline, ou dans un milieu fortement basique, des esters d'acides gras tels que ceux obtenus dans les graisses et les huiles comestibles.
La saponification est connue depuis des siècles. Au début, il a été utilisé pour déterminer la composition de certains triglycérides communs, comme la stéarine.
Le chimiste qui a découvert la réaction pour la première fois, l'a utilisé pour démontrer que la stéarine n'était vraiment rien de plus que l'union entre un alcool, dans ce cas, la glycérine ou le glycérol, avec trois molécules d'un acide gras appelé acide stéarique.
Réaction de saponification
La saponification Il s'agit d'une réaction d'hydrolyse d'un ester d'acide gras. Cela signifie que la liaison ester est rompue (lyse - casser) au moyen de l'action de l'eau (Hydroélectricité - eau). Pour cela, l'utilisation d'une base forte comme l'hydroxyde de sodium ou l'hydroxyde de potassium est requise.
En tant que produits, un sel acide est obtenu (qui est le savon lui-même) et un alcool, comme indiqué ci-dessous:

Mécanisme de réaction de saponification
Le mécanisme de cette réaction est un processus à trois étapes, qui commence par une attaque de l'ion hydroxyde, puis l'élimination de l'alcool et enfin la formation de sel.
-
Étape 1: Attaque d'ions hydroxyde
La première étape, et la raison pour laquelle il est nécessaire d'ajouter de l'hydroxyde de sodium ou une autre base forte est l'attaque de l'hydroxyde à l'ester:
Peut vous servir: chitosano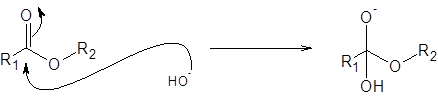
-
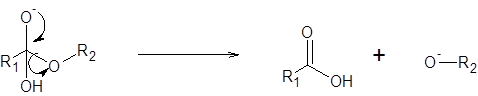
Étape 2: Élimination de l'alcool sous la forme d'un ion alcoxyde
À ce stade, la paire d'électrons d'oxygène pousse l'alcool et la sépare de l'ester sous la forme d'un ion alcoxyde. Cet ion est une base très forte. En plus de l'alcoxyde, une molécule d'acide carboxylique est également formée (qui est un acide gras).
-
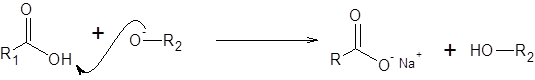
Étape 3: Formation du sel
L'ion alcoxyde formé à l'étape précédente est une base très forte et élimine facilement le proton à l'acide carboxylique. Ce faisant, ça fait de l'acide.
Triglycérides
En général, la réaction de saponification est effectuée avec des graisses ou des huiles, soit des légumes ou des animaux.
 Les huiles végétales, comme l'huile d'olive, sont généralement utilisées pour fabriquer des savons de saponification
Les huiles végétales, comme l'huile d'olive, sont généralement utilisées pour fabriquer des savons de saponification Les esters qui sont présents dans ces graisses et les huiles sont presque toujours des triglycérides ou des esters d'acide gras avec un alcool spécial appelé glycérol ou glycérine.
Dans ces cas, la réaction de saponification est considérée comme:
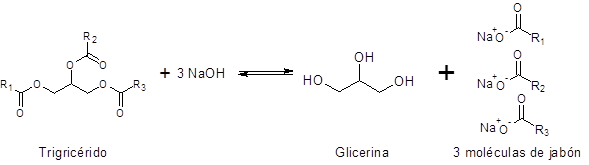
R1, R2 et r3 Ils représentent les chaînes d'acides gras. Comme il existe de nombreux acides gras différents, la saponification peut fournir des savons différents avec différents savons.
Produits de saponification
Selon l'huile de démarrage ou la graisse et quelle base est utilisée, des savons avec différentes propriétés seront obtenus.
- Par exemple, L'utilisation d'hydroxyde de sodium ou de potassium donnera comme produit un sel de sodium ou un sel de potassium (un savon de sodium ou de potassium). En général, les savons de potassium ont moins de point de fusion que le sodium, et certains sont même liquides à température ambiante.
De même, les caractéristiques des acides gras qui font partie de l'ester affecteront également les propriétés du savon résultant. Plus la chaîne est longue, plus son point de fusion est grand.
Pour cette raison, lorsque vous souhaitez préparer des savons liquides, par exemple, les acides gras sont sélectionnés avec des chaînes plus courtes et hydrolysées avec de l'hydroxyde de potassium au lieu de sodium.
Importance de la saponification
La saponification est une réaction très importante.
- Au niveau industriel, c'est la réaction qui est utilisée pour la fabrication de tous les savons de pâtes, tels que des savons à main ou des savons de lavage des barres.
- D'un autre côté, il est également fréquemment utilisé comme première étape pour obtenir des acides gras, qui sont ensuite utilisés dans une grande variété d'industries telles que la fabrication des cosmétiques.
- Dans d'autres cas, les acides gras sont souvent utilisés comme solvants ou agents dispersés dans la fabrication de peintures, bien qu'il soit plus courant d'atteindre les huiles minérales dans ces cas.
- En plus de cela, cette réaction est également utilisée pour nettoyer toute surface grasse comme l'intérieur des fours ou la surface des cuisines.
Dans les cas où les graisses sont très proches de la surface ou sont des graisses. De cette façon, la graisse devient du savon, le savon se dissout dans l'eau et la surface est propre.
Peut vous servir: carbocation: formation, caractéristiques, types, stabilitéExemples de réactions de saponification
-
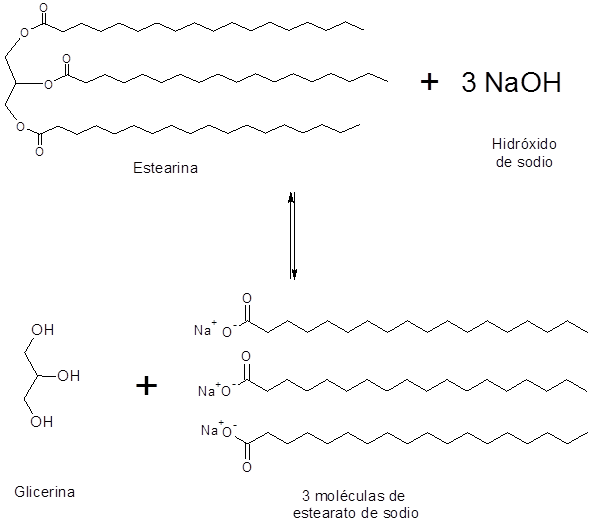
Saponification de la stéarine
La stéarine est un triglycéride qui contient trois molécules d'acide stéarique liées à la glycérine. Sa saponification produit trois molécules de savon, dans ce cas, sodium ou stéarate de potassium.
-
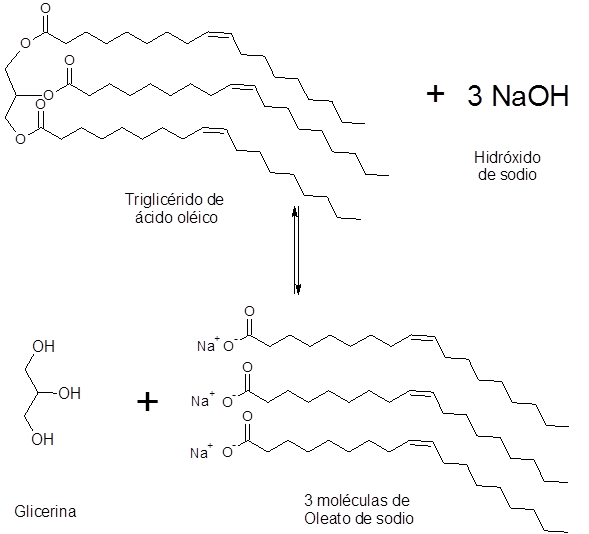
Saponification de l'acide oléique
Les huiles d'olive et de tournesol contiennent plus de 80% d'acide oléique. Ceci est une graisse insaturée qui a 18 chaînes de carbone. La saponification de ces huiles produit, entre autres, l'huile de sodium.
-
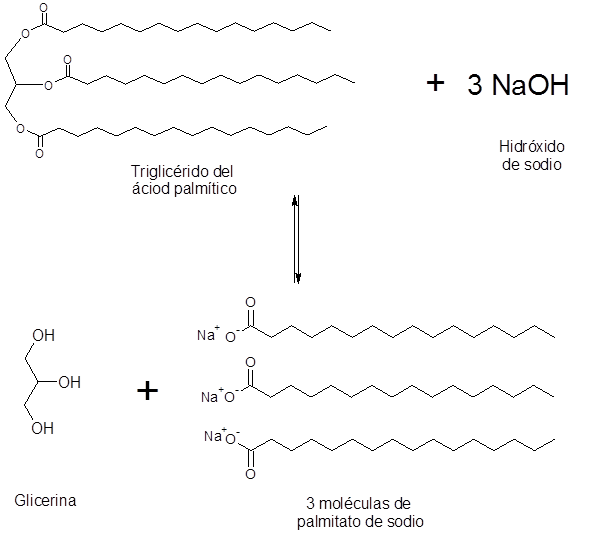
Saponification de l'acide palmitique
L'acide palmitique est un acide gras saturé à long terme contenant 16 atomes de carbone. C'est l'acide gras le plus important de l'être humain. C'est le principal acide gras saturé de notre corps.
Dans la nourriture, l'acide palmitique est l'un des principaux composants de la graisse animale, donc les savons préparés à partir de graisses tels que le beurre de bovins, contiennent principalement du palmitate de sodium ou de potassium.
De plus, l'acide palmitique forme plus de 40% d'huile de palme (d'où son nom). En fait, la saponification de l'huile de palme est la principale source industrielle d'acide palmitique dans le monde entier.