Sels biologiques
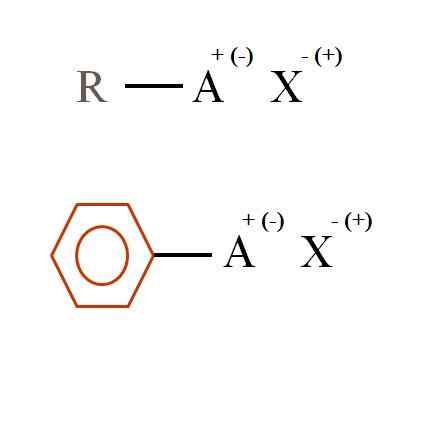
- 4358
- 22
- Anaïs Julien
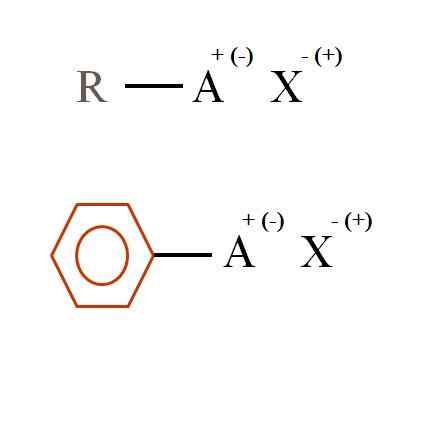 Deux formules chimiques générales pour les sels biologiques. Source: Gabriel Bolívar
Deux formules chimiques générales pour les sels biologiques. Source: Gabriel Bolívar Quels sont les sels biologiques?
Le Sels biologiques Ils sont un nombre dense de composés ioniques avec d'innombrables caractéristiques. Auparavant dérivé d'un composé organique, qui a subi une transformation qui lui permet d'être une cargaison, et que son identité chimique dépend de l'ion associé.
Dans l'image supérieure, deux formules chimiques très générales sont indiquées pour les sels biologiques. Le premier, R-Ax, est interprété comme un composé dans le travail de la structure du carbone, ou le groupe A, porte une charge positive + ou négative (-).
Comme on peut le voir, il existe une liaison covalente entre R et A, R-A, mais à son tour, il a une charge formelle qui attire (ou repousse) à l'ion x. Le signe de charge dépendra de la nature de A et de l'environnement chimique.
Si c'était positif, combien de x pouvaient interagir? Avec un, étant donné le principe de l'électroneutralité (+ 1-1 = 0). Cependant, quelle est l'identité de x? L'anion x pourrait être le CO32-, nécessitant deux cations RA+; Un halogénide: f-, CL-, BR-, etc.; ou même un autre composé-. Les options sont incalculables.
De même, un sel organique peut être aromatique, illustré dans l'anneau brun benzénique. Sel de benzoate de cuivre (ii), (c6H5Roucouler)2Cu, par exemple, se compose de deux anneaux aromatiques avec des groupes carboxy chargés négativement, qui interagissent avec le cation Cu2+.
Propriétés physiques et chimiques des sels biologiques
De l'image, il peut être affirmé que les sels organiques se composent de trois composants: l'organique, R ou AR (l'anneau aromatique), un porte-atome ou un porte-groupe de la charge ionique A, et un contre-ion x.
Tout comme l'identité et la structure chimique sont définies par de tels composants, de la même manière que leurs propriétés dépendent d'eux.
De ce fait, certaines propriétés générales qui répondent à la grande majorité de ces sels peuvent être résumés.
Peut vous servir: Numéro d'oxydation: concept, comment le faire sortir et des exemplesMasses moléculaires élevées
En supposant des anions inorganiques mono ou polyvalents, les sels biologiques ont généralement des masses moléculaires beaucoup plus grandes que les sels inorganiques. Cela est principalement dû au squelette gazéifié, dont les liaisons C-C simples et ses atomes d'hydrogène fournissent beaucoup de masse au composé.
Par conséquent, ce sont les responsables de leurs masses moléculaires élevées.
Amphiphylique et tensioactifs
Les sels organiques sont des composés amphiphiles, c'est-à-dire que leurs structures ont à la fois des extrêmes hydrophiles et hydrophobes.
Quels sont ces extrêmes? R ou AR représentent l'extrémité hydrophobe, car leurs atomes de C et H n'ont pas une grande affinité pour les molécules d'eau.
POUR+(-), Le groupe de porteurs d'atome ou de cargaison est l'extrémité hydrophile, car il contribue au moment dipolaire et interagit avec le dipôle formant l'eau (RA+ Oh2).
Lorsque les régions hydrophiles et hydrophobes sont polarisées, le sel amphiphile devient un tensioactif, une substance largement utilisée pour l'élaboration des détergents et non-dalmage.
Points d'ébullition élevés ou fusion
Comme les sels inorganiques, les sels biologiques ont également des points de fusion et d'ébullition élevés, en raison des forces électrostatiques qui régissent en phase liquide ou solide.
Cependant, ayant un composant organique R ou AR, d'autres types de van der Waals (Londres, Dipolo-dipolo, ponts d'hydrogène) participent d'une manière ou d'une autre avec l'électrostatique.
Pour cette raison, les structures solides ou liquides des sels biologiques sont, en premier lieu, plus complexes et variés. Certains d'entre eux peuvent même se comporter comme cristaux liquides.
Acidité et basicité
Les sels biologiques sont généralement des acides ou des bases plus forts que les sels inorganiques. En effet+-H. Ensuite, en contact avec une base, donnez à nouveau le proton pour être un composé neutre:
Il peut vous servir: strontium: histoire, structure, propriétés, réactions et utilisationsRampe+H + b => ra + hb
Le H appartient à A, mais est écrit, car il intervient dans la réaction de neutralisation.
D'un autre côté, RA+ Il peut s'agir d'une grande molécule, incapable de former des solides avec un réseau cristallin stable avec un anion hydroxyle ou une oxhydrilo OH-.
Quand il en est ainsi, le Salt Ram+Oh- Il se comporte comme une base forte; Même aussi basique que Naoh ou Koh:
Rampe+Oh- + Hcl => racl + h2SOIT
Note dans l'équation chimique que l'anion Cl- remplacer oh-, formant le sali+CL-.
Utilisations des sels biologiques
L'utilisation de sels biologiques variera en fonction de l'identité de R, AR, A et X. De plus, l'application à laquelle ils sont alloués dépend également du type de solide ou de liquide qu'ils forment. Certaines généralités à cet égard sont:
- Ils servent de réactifs pour la synthèse d'autres composés organiques. Rax peut agir comme un «donateur» de la chaîne R pour ajouter à un autre composé remplaçant un bon groupe sortant.
- Ce sont des surfactants, ils peuvent donc également être utilisés comme lubrifiants. Les sels de carboxylalate en métal sont utilisés à cet effet.
- Ils permettent de synthétiser un large éventail de colorants.
Exemples de sels biologiques
Carboxylate
Les acides carboxyliques réagissent avec un hydroxyde dans une réaction de neutralisation, provoquant des sels de carboxylalate: RCOO- M+; où m+ Il peut s'agir de n'importe quel cation métallique (na+, PB2+, K+, etc.) ou le cation Ammonium NH4+.
Les acides gras sont des acides carboxyliques à longue chaîne, ils peuvent être saturés et insaturés. L'acide palmitique est parmi les saturés (choisissez3(Ch2)14COOH). Cela provient du sel palmitate, tandis que l'acide stéarique (CHO3(Ch2)16COOH FORME LE SEL STEAR. Les savons sont constitués de ces sels.
Peut vous servir: loi générale sur le gazDans le cas de l'acide benzoïque, C6H5COOH (où c6H5- C'est un anneau de benzène), quand il réagit avec une base forme les sels du benzoate. Dans tous les carboxilats, le groupe -co- Représente un (Rax).
Lithium diabilcupratos
La journée au lithium est utile dans la synthèse organique. Sa formule est [R-Cu-R]-Li+, dans lequel l'atome de cuivre transporte une charge négative. Ici, le cuivre représente l'atome de l'image.
Sels de sulfonium
Ils sont formés à partir de la réaction d'un sulfure organique avec un halogogénide d'alkyle:
R2S + r'x => r2R+X
Pour ces sels, l'atome de soufre porte une charge formelle positive (S+) avoir trois liens covalents.
Saux d'Oxyio
De même, les éthers (les analogues oxygénés des sulfures) réagissent avec les hydraceides pour former les salles oxy:
Ror '+ hbr ro+Hr '+ br-
Le proton d'acide HBR est systématiquement lié à l'atome d'oxygène éther (R2SOIT+-H), le charger positivement.
Salts Amina
Les amines peuvent être primaires, secondaires, tertiaires ou quaternaires, tout comme leurs sels. Tous sont caractérisés par un atome de H lié à l'atome d'azote.
Ainsi, RNH3+X- Il s'agit d'un sel d'amine primaire; R2NH2+X-, d'Amina secondaire; R3NH+X-, d'amine tertiaire; et r4N+X-, de l'amine quaternaire (sel d'ammonium quaternaire).
Sels de diazonium
Enfin, les sels de diazonium (RN2+X-ou ariladiazonium (ARN2+X-), ils représentent le point de départ de nombreux composés organiques, en particulier les colorants azoïques.
Les références
- Francis a. Écaille de tortue. Chimie organique (sixième édition, pp. 604-605, 697-698, 924). Mc Graw Hill.
- Graham Salomons t.W., Craig B. Fryhle. Chimie organique. Amines (10e édition.). Wiley Plus.
- Wikipedia (2018). Sel (chimie). Pris de: dans.Wikipédia.org
- Steven A. Hardinger (2017). Glossaire illustré de la chimie biologique: sels. Récupéré de: Chem.Ucla.Édu
- Chevron Oronite (2011). Carboxylate. [PDF]. Récupéré de: Oronite.com

