Découverte de Renio, propriétés, structure, utilisations

- 4333
- 536
- Mlle Ambre Dumont
Il Renio C'est un élément métallique dont le symbole chimique est Re et est situé dans le groupe 7 du tableau périodique, deux positions sous le manganèse. Partagez avec cette propriété et Technecio de plusieurs nombres ou états d'oxydation, de +1 à +7. Forme également un anion appelé Perrenato, détenu4-, Analogue au permanganate, MNO4-.
Ce métal est l'un des plus rares et rares, donc son prix est élevé. Il est extrait comme un sous-produit de la molybdène et de l'exploitation de cuivre. L'une des propriétés les plus pertinentes de Renio est son point de fusion élevé, à peine surmonté par le carbone et le tungstène, et sa grande densité, étant le double de celui du plomb.
 Sphère de métal Renio. Source: Images haute résolution des éléments chimiques / CC par (https: // CreativeCommons.Org / licences / par / 3.0)
Sphère de métal Renio. Source: Images haute résolution des éléments chimiques / CC par (https: // CreativeCommons.Org / licences / par / 3.0) Sa découverte a des nuances controversées et malheureuses. Le nom de «Renio» dérive du mot latin «Rhenus», ce qui signifie Rin, la célèbre rivière allemande près du site où les chimistes allemands qui ont isolé et identifié ce nouvel élément fonctionnaient.
Renio a de nombreuses utilisations, parmi lesquelles le raffinement de l'octane de l'essence est.
[TOC]
Découverte
L'existence de deux éléments lourds avec des caractéristiques chimiques similaires à ceux du manganèse prédisait déjà depuis le 1869, par le tableau périodique du chimiste russe Dmitri Mendeleev. Cependant, on ne sait pas ce que devrait être leurs nombres atomiques; Et c'était ici en 1913 lorsque la prédiction du physicien anglais Henry Moseley a été présentée.
Selon Moseley, ces deux éléments appartenant au groupe de manganèse doivent avoir des numéros atomiques 43 et 75.
Quelques années auparavant, cependant, le chimiste japonais Masataka Ogawa avait découvert l'élément présumé 43 dans un échantillon de Torianita minéral. Après avoir annoncé ses résultats en 1908, il a voulu baptiser cet élément avec le nom de «Niponio». Malheureusement, les chimistes à l'époque ont montré que Ogawa n'avait pas découvert l'élément 43.
Il peut vous servir: Cycloalques: structure chimique, propriétés, nomenclatureEt donc, d'autres années se sont écoulées lorsque, en 1925, trois chimistes allemands: Walter Noddack, Ida Noddack et Otto Berg, a trouvé l'élément 75 dans des échantillons minéraux Columbita, Gadolinite et Molybdenite. Ceux-ci lui ont donné le nom de Renio, en l'honneur de la Rin Rin d'Allemagne («Rhenus», en latin).
L'erreur de Masataka Ogawa était d'avoir la disace déposée dans l'identification de l'élément: il avait découvert Renio, pas l'élément 43, appelé Tecnecio aujourd'hui.
Propriétés Renio
 Situation Renio dans le tableau périodique. !Original: Ahoteseiervector: Sushant Savla / CC By-S (https: // CreativeCommons.Org / licences / by-sa / 3.0)
Situation Renio dans le tableau périodique. !Original: Ahoteseiervector: Sushant Savla / CC By-S (https: // CreativeCommons.Org / licences / by-sa / 3.0) Apparence physique
Renio est généralement commercialisé sous forme de poussière grisâtre. Ses pièces métalliques, généralement des gouttes sphériques, sont gris argentés, qui sont également très brillants.
Masse molaire
186 207 g / mol
Numéro atomique
75
Point de fusion
3186 ºC
Point d'ébullition
5630 ºC
Densité
-À température ambiante: 21,02 g / cm3
-Juste au point de fusion: 18,9 g / cm3
Renio est un métal qui est presque deux fois plus dense que le même plomb. Ainsi, une sphère Renio qui pèse 1 gramme peut être assimilée à un cristal de plomb robuste de la même masse.
Électronégativité
1.9 sur l'échelle Pauling
Énergies d'ionisation
Premièrement: 760 kJ / mol
Deuxième: 1260 kJ / mol
Troisième: 2510 kJ / mol
Capacité thermique molaire
25,48 J / (mol · k)
Conductivité thermique
48,0 w / (m · k)
Résistivité électrique
193 nΩ · m
Dureté mohs
7
Isotopes
Les atomes de Renio sont présentés dans la nature comme deux isotopes: 185RE, avec une abondance de 37,4%; et 187Re, avec une abondance de 62,6%. Renio est l'un de ces éléments dont l'isotope le plus abondant est radioactif; Cependant, la demi-vie de 187Re est très grand (4.12 · 10dix années), il est donc pratiquement considéré comme stable.
Peut vous servir: nickel: historique, propriétés, structure, utilisations, risquesRéactivité
Renio métallique est un matériau résistant. Quand il le fait, son oxyde, re2SOIT7, Il est volatilisé à des températures élevées et brûle avec une flamme verte jaunâtre. Les pièces de Renio résistent à l'attaque de HNO3 concentré; Mais chaud, se dissout pour générer du dioxyde d'acide rénique et d'azote, qui colore la solution:
Re + 7hno3 → Hreo4 + 7 Non2 + 3h2SOIT
La chimie de Renio est vaste, car elle est capable de former des composés avec un large éventail de nombres d'oxydation, ainsi que d'établir une liaison quadrupolo entre deux atomes de Renio (quatre liaisons covalentes)).
Structure et configuration électroniques
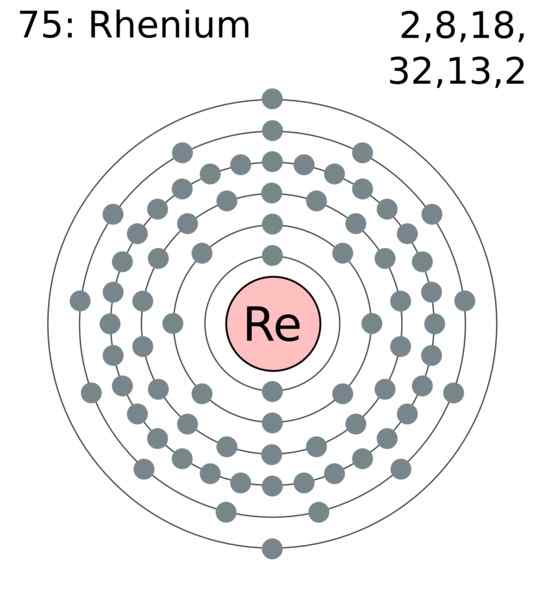 Couche d'électrons Renio. Auteur: Utilisateur: Gregrobson (Greg Robson). Wikimedia Commons
Couche d'électrons Renio. Auteur: Utilisateur: Gregrobson (Greg Robson). Wikimedia Commons Les atomes de Renio sont regroupés dans leurs cristaux pour provoquer une structure hexagonale compacte, HCP, qui se caractérise par un très dense. Cela est d'accord avec le fait d'être un métal de grande densité. Le lien métallique, produit du chevauchement de ses orbitales externes, maintient les atomes redéquit fortement cohérent.
Dans ce lien métallique, Rere, les électrons de Valencia participent, qui sont selon la configuration électronique:
[XE] 4F14 5 D5 6s2
En principe, ce sont les orbitales 5D et 6S qui se chevauchent pour compacter les atomes RE dans la structure HCP. Notez que vos électrons ajoutent un total de 7, correspondant au numéro de votre groupe dans le tableau périodique.
Nombres d'oxydation
La configuration électronique de Renio aperçoit une fois que son atome est capable de perdre jusqu'à 7 électrons, pour devenir l'hypothétique Cation re7+. Lorsque l'existence du RE est supposée7+ Dans n'importe quel composé de Renio, par exemple, dans le re2SOIT7 (Concernant27+SOIT72-), On dit qu'il a un nombre d'oxydation de +7, re (vii).
Les autres nombres d'oxydation positifs pour Renio sont: +1 (re+), +2 (re2+), +3 (re3+), Et ainsi de suite à +7. De même, Renio peut gagner des électrons devenant un anion. Dans ces cas, il est dit qu'il a un numéro d'oxydation négatif: -3 (re3-), -2 (re2-) et -1 (re-).
Il peut vous servir: hydrolyse: qu'est-ce que c'est et des exemples de réactionsApplications
De l'essence
Renio, avec Platinum, est utilisé pour créer des catalyseurs qui augmentent le degré d'octane d'essence, tout en diminuant sa teneur en plomb. D'un autre côté, les catalyseurs de Renio sont destinés à plusieurs réactions d'hydrogénation, ce qui est en raison de leur résistance à l'empoisonnement à l'azote, au phosphore et au soufre.
Superleations réfractaires
Renio est un produit métallique réfractaire de son point de fusion élevé. C'est pourquoi les alliages de nickel sont ajoutés pour les retourner réfractaires et résistants aux grandes pressions et températures. Ces superleations sont principalement utilisées pour la conception de turbines et de moteurs pour les navires aérospatiaux.
Filaments de tungstène
Renio peut également former des alliages avec du tungstène, ce qui améliore sa ductilité et, par conséquent, facilite la fabrication de filaments. Ces filaments rénio-tungstène sont utilisés comme sources de rayons X, et pour la conception de thermocuplaes capables de mesurer des températures jusqu'à 2200 ° C.
De même, ces filaments Renio ont été utilisés une fois pour des clignotants caméras archaïques, et actuellement pour les lampes d'équipement sophistiquées; comme le spectrophotomètre de masse.
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Sarah Pierce. (2020). Rhénium: utilisation, histoire, faits et isotopes. Étude. Récupéré de: étudier.com
- Centre national d'information sur la biotechnologie. (2020). Rhénium. Base de données PubChem., CID = 23947. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Wikipédia. (2020). Rhénium. Récupéré de: dans.Wikipédia.org
- Docteur. Doug Stewart. (2020). Faits d'élément rhénium. Récupéré de: Chemicool.com
- Eric Scerri. (18 novembre 2008). Rhénium. Chimie dans ses éléments. Récupéré de: Chemistryworld.com
- « Pas d'électrolytes et d'exemples caractéristiques
- Alfa-cootogl les propriétés, fonctions et applications »

