Réduction (chimie)
- 2213
- 567
- Adam Mercier
 Réduction des arbres argentés. Source: Gabriel Bolívar
Réduction des arbres argentés. Source: Gabriel Bolívar Quelle est la réduction?
La réduction C'est toute cette réaction chimique où les atomes de l'un des réactifs finissent par gagner des électrons, qui peuvent également être vus de cette manière: sa vacance ou son «inconfort» électronique est réduit. Un atome gagne des électrons lorsqu'une espèce les donne, c'est-à-dire lorsqu'il est oxydé.
Ce type de réaction ne peut pas être donné par lui-même: si une espèce accepte les électrons, un autre doit nécessairement leur donner. Sinon, la matière serait créée à partir de rien, réduisant les atomes après avoir gagné des électrons vides. Par conséquent, c'est un semi-lumière redox (réduction / oxydation).
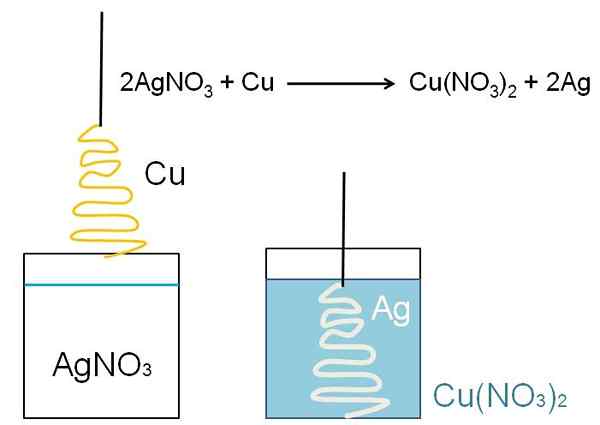
Un exemple illustratif de la réduction qui peut être montré dans les salles de classe est la réaction entre une surface de cuivre métallique et une solution aqueuse de nitrate d'argent, Agno3.
Dans la solution, l'argent est comme cations agir+, chargé positivement. Ceux-ci, lorsqu'ils interagissent avec la surface du cuivre, sous la forme d'un arbre de Noël, les électrons sont tirés des atomes de cuivre. Lorsque cela se produit, le cuivre remplace l'argent dans du nitrate de sel, et par conséquent, le nitrate de cuivre est formé, non3)2.
Cations2+ à côté de non3- Ils ont le bleuâtre la solution, et l'argent comprend l'arbre de Noël comme s'ils le couvraient de neige.
Quelle est la réduction?
Dans la réduction, il a déjà été dit qu'une espèce gagne des électrons. Comment cela peut-il être vérifié dans une équation chimique? Par exemple, dans l'équation de réaction entre Cu et Agno3, Comment savoir quand la réduction se produit? Pour le vérifier, il est nécessaire de déterminer le nombre ou l'état d'oxydation.
Peut vous servir: électronégativitéLes éléments, dans leurs états naturels, ont comme définition un état d'oxydation égal à zéro, car il est supposé qu'ils n'ont pas perdu ou gagné des électrons. Ainsi, les métaux solides n'ont aucun état d'oxydation. Ainsi, l'argent passe de +1 (AG+) A 0 (AG). La charge d'un ion métallique est égale à son état d'oxydation.
D'un autre côté, les électrons provenaient du cuivre: se déplaçant de 0 (Cu) à +2 (Cu2+). L'anion nitrate, non3- reste inaltérable tandis que les deux métaux échangent des électrons. Par conséquent, l'équation peut être écrite comme:
2ag+ + Cu => 2ag + cu2+
Notez que les charges et les atomes sont équilibrés.
Cela consiste en la réduction chimique: dans le gain d'électrons qui font les états d'oxydation des atomes que les électrons gagnent moins positifs.
Nombre d'oxygène
L'oxygène sont des atomes très électronégatifs et oxydants, donc lorsqu'une forme d'atome composée avec eux (comme les oxydes), ils ont des états d'oxydation positifs. Plus le nombre d'oxygène interagissant avec l'atome est élevé, plus son oxydation sera positive. Ou qu'est-ce qui est le même, il est plus oxydé.
Par conséquent, lorsqu'un composé a moins d'atomes d'oxygène, il est dit qu'il est moins oxydé. C'est-à-dire que l'atome perd moins d'électrons.
Un exemple classique peut être vu dans le monoxyde et le dioxyde de carbone. Pour CO, le carbone a un état d'oxydation de +2, tandis que pour CO₂, son statut d'oxydation est +4.
Donc, si dans une réaction, le CO₂ est transformé en CO, on dit qu'une réduction se produit, car le carbone interagit désormais avec un oxygène et non deux. Pour la réaction opposée, le co-transformant, il est question d'une oxydation du carbone.
Peut vous servir: chlorure ferreux (FECL2): structure, utilisations, propriétésCela s'applique à tous les atomes, en particulier les métaux de leurs oxydes métalliques. Par exemple, CRO2 (Cr4+) et CRO3 (Cr6+).
Dans les équations chimiques, où une espèce perd de l'oxygène tandis que l'autre espèce la gagne, on dit qu'un transfert d'oxygène se produit.
Atome électronégatif
Il peut toujours être déterminé s'il y a eu une réduction en modifiant l'état d'oxydation en une valeur moins positive. Comme vous venez de l'expliquer, un moyen rapide de le remarquer sans même faire les calculs est d'observer s'il y a une diminution des atomes d'oxygène dans un composé.
La même chose peut se produire avec tout autre atome plus électronégatif que l'atome qui gagne ou perd des électrons.
Par exemple, si le CF4 réagit de telle manière qu'il devient cho4, On dit alors qu'une réduction s'est produite, car le fluorure est beaucoup plus électronégatif que l'atome d'hydrogène. En conséquence, le carbone est moins oxydé dans Cho4 que dans le CF4, ce qui est de même pour dire qu'il a été réduit.
Exemples
Réduction de la chimie organique
L'exemple du CF4 et ch4 reflète ce qui se passe dans les réactions organiques, où la réduction de la charge partielle d'un atome est considérée comme un gain électronique. Cela s'applique considérablement lorsque l'on considère la réduction des groupes fonctionnels oxygénés.
Par exemple, considérez les groupes ROH, RCHO et COOH. Le premier correspond aux alcools, où le carbone est lié à l'oxygène (C-OH); Le second est le groupe aldéhyde, où le carbone forme une double liaison avec l'oxygène et est également lié à un hydrogène (C = O-H), et le troisième est le groupe carboxyle.
Peut vous servir: hydroxyde de Beryl (être (oh) 2)Dans le groupe carboxyle, le carbone forme une double liaison avec un O, et un lien simple avec un autre O (ho-c = o).
Par conséquent, une réduction se produit si un acide carboxylique est transformé en alcool:
Rcooh => roh
Extraction des métaux
La réduction chimique est extrêmement importante dans les processus d'extraction des métaux de leurs minéraux. Certaines réactions sont:
HGS + O2 => Hg + donc2
Le sulfure de mercure est réduit au mercure métallique.
Cu2S + O2 => 2cu + donc2
Le sulfure de cuivre en cuivre métallique est réduit.
2zns + 3o2 => 2zno + 2so2
ZnO + C => Zn + Co (remarquez le transfert d'O).
Le sulfure de zinc est d'abord réduit à son monoxyde puis à sa forme métallique.
Foi2SOIT3 + 3CO => 2FE + 3CO2
L'oxyde ferrique est réduit en fer métallique.
Wo3 + 3h2 => W + 3h2SOIT
Et le trioxyde de tungstène est réduit en tungstène métallique.
Comme exercice, le nombre d'oxydation du métal peut être déterminé avant d'être réduit.
Autres exemples
- L'ion fer (III) peut être réduit en fer (II):
- Etino peut être réduit à eteno:
- Etanal peut être réduit à l'éthanol
Les références
- Réactions d'oxydation-réduction. Chem récupéré.Bibliothèque.org.
- La définition de la réduction de la chimie. Récupéré de Thoughtco.com.




