Préparation réactive de Grignard, applications, exemples
- 1567
- 218
- Adam Mercier
Il Réactif de Grignard Il s'agit d'une famille de composés organométalliques qui a comme formule générale, où R représente un hydrocarbure radicalaire: un groupe alkyle, aryle, vinyle, etc. Pendant ce temps, X représente un halogène: iode, brome ou chlore. Le fluor n'est pas utilisé dans le réactif de Grignard.
Le réactif doit son nom à son créateur, le chimiste français Victor Grignard en 1900, faisant le prix Nobel en 1912 pour son travail. Il est préparé par réaction d'un organhaleogène avec du magnésium, de préférence dans une atmosphère d'azote.
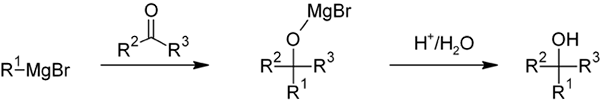 Schéma général de la réaction de Grignard pour le BR
Schéma général de la réaction de Grignard pour le BR Dans cette réaction, l'éther Dietyl ou le tétrahydrofurano (THF) est généralement utilisé comme solvant (THF). Pendant ce temps, l'eau doit être évitée, car elle réagit fortement avec le réactif de Grignard. Ce réactif est une base forte et un nucléophile, c'est-à-dire lorsqu'il réagit, il abandonne quelques électrons.
Le réactif de Grignard réagit avec presque tous les composés organiques, à l'exception des hydrocarbures, des éthers et des amines tertiaires. Les réactions de Grignard visent la synthèse de nouveaux composés en créant de nouvelles liaisons carbone-carbone.
Ils réagissent également avec les composés halogénés de certains métaux pour former leurs dérivés alcaux.
[TOC]
Préparation du réactif de Grignard
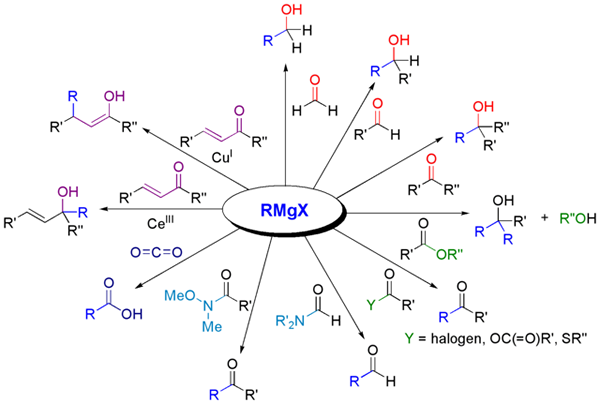 Le réactif de Grignard et ses réactions avec plusieurs composés carbonyle. Source: Calvero via Wikipedia.
Le réactif de Grignard et ses réactions avec plusieurs composés carbonyle. Source: Calvero via Wikipedia. Réactifs
Les réactifs de Grignard sont préparés en ajoutant aux organohalogènes (RX), petits morceaux de magnésium. Le magnésium doit être précédemment activé, car il est généralement présenté sous la forme de bandes recouvertes d'oxyde de magnésium, ce qui les impapaçait à être utilisés dans la réaction de Grignard.
Solvants et équation
La préparation est réalisée dans un ballon contenant de l'éther Dietyl ou de la tétrahydrofurano comme solvant, avec organhalogène (RX) et magnésium. Le ballon est doté d'un condenseur de reflux, afin de réduire la perte du solvant en raison de l'évaporation.
Peut vous servir: séparation magnétiqueLes composants du mélange sont chauffés dans un bain-marie pendant 20 ou 30 minutes, la réaction suivante se produisant:
Rx + mg → rmgx
Les solvants utilisés doivent être signés, c'est-à-dire sans hydrogènes acides. L'eau et les alcools doivent être évités, car ils protons le réactif de Proton Grignard, provoquant sa destruction:
Rmgx + h2O → Rh + mg (OH) x
Cela se produit parce que le carbone réactif de Grignard est très nucléophile, ce qui conduit à la formation d'un hydrocarbure. Il est également recommandé que la réaction soit effectuée dans une atmosphère d'azote, pour éviter l'action de l'oxygène.
Le réactif de Grignard est sensible à l'humidité et à l'oxygène, donc des tests de son bon état sont effectués, en utilisant des indicateurs de cela, comme le menthol, la fenantroline ou la 2,2'-biperidine.
Applications
La principale application synthétique du réactif de Grignard est sa réaction avec les composés qui ont des groupes carbonyle pour la production d'alcool. La formation de liaisons carbone-carbone est rapide et exothermique lorsque le réactif de Grignard réagit avec un aldéhyde ou une cétone.
Réaction réactive de Grignard avec le formaldéhyde
Le formaldéhyde réagit avec le réactif de Grignard pour créer un alcool primaire. Cette réaction se produit en deux étapes.
Dans la première étape, le formaldéhyde réagit avec le réactif de Grignard en présence du solvant d'éther alimentaire, formant un complexe de formaldéhyde et le réactif de Grignard.
À une deuxième étape, l'hydrolyse du complexe antérieur est produite par l'action de l'acide sulfurique dilué (h3SOIT+), produire un alcool primaire qui présente un carbone supplémentaire au nombre de carbones présentés par le réactif de Grignard.
Il peut vous servir: Anisol: structure, propriétés, nomenclature, risques et utilisationsPour simplifier la représentation du processus global, les deux étapes sont synthétisées en une pour apparaître comme si le processus de formation d'alcool primaire s'est produit en une seule étape:
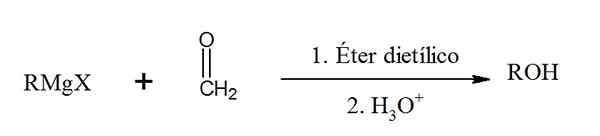 Réaction entre le formaldéhyde et un réactif de Grignard. Source: Gabriel Bolívar via Chemsketch.
Réaction entre le formaldéhyde et un réactif de Grignard. Source: Gabriel Bolívar via Chemsketch. Réaction de réaction de Grignard avec un aldéhyde
Les aldéhydes lorsqu'ils réagissent avec le réactif de Grignard proviennent d'un alcool secondaire. L'équation est similaire à celle ci-dessus, avec la différence que la formule d'alcool résultante est R2Choh.
Réaction du réactif Grignard avec un Cetona
Le réactif de Grignard lorsqu'il réagit avec un cétone provient un alcool tertiaire:
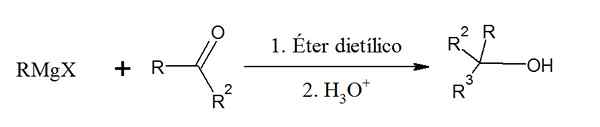 Réaction du réactif Grignard avec un Cetona. Source: Gabriel Bolívar via Chemsketch.
Réaction du réactif Grignard avec un Cetona. Source: Gabriel Bolívar via Chemsketch. Notez comment ce réactif est utilisé pour obtenir des alcools avec le plus grand nombre de carbones.
Réaction de réactif Grignard avec un ester
Dans cette réaction de synthèse, l'ester méthylique et l'ester éthylique sont utilisés plus fréquemment. Deux moles de réactif Grignard sont nécessaires par Mol of Ester. La première taupe de Grignard réagit avec l'ester, formant une cétone et un métaximagnesio halogénide (CH2OMGX):
Rmgx + r'-c (o) -och3 → R'-C (O) -R + CH2OMGX
Pendant ce temps, la deuxième taupe de Grignard réagit avec la cétone pour créer un alcool tertiaire. Cette réaction était déjà représentée dans l'image précédente.
Réaction du réactif de Grignard avec l'époxyde
Dans cette réaction, un alcool primaire est formé:
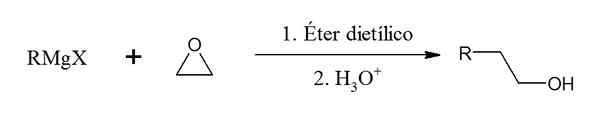 Réaction entre le réactif de Grignard et l'époxyde. Source: Gabriel Bolívar via Chemsketch.
Réaction entre le réactif de Grignard et l'époxyde. Source: Gabriel Bolívar via Chemsketch. Réaction de réactif Grignard avec le dioxyde de carbone
Lorsque le réactif de Grignard réagit avec le dioxyde d'acide carboxylique.
Peut vous servir: ayaroínaCertaines des applications mentionnées ici étaient dans la première image.
Exemples
Exemple 1
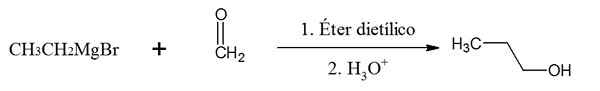 Réaction de bromure d'éthylmagnésium avec le formaldéhyde. Source: Gabriel Bolívar via Chemsketch.
Réaction de bromure d'éthylmagnésium avec le formaldéhyde. Source: Gabriel Bolívar via Chemsketch. Notez que le segment éthylique se lie au groupe CHO2 du formaldéhyde pour former le 1-propanol, un alcool primaire.
Exemple 2
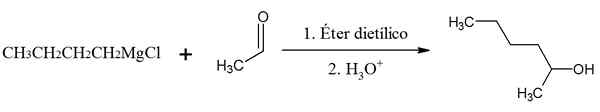 Réaction de chlorure de butilmagnesium avec éthanal. Source: Gabriel Bolívar via Chemsketch.
Réaction de chlorure de butilmagnesium avec éthanal. Source: Gabriel Bolívar via Chemsketch. Dans cette réaction, un alcool secondaire est produit: 2-hexanol.
Exemple 3
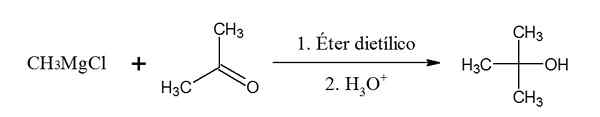 Réaction de chlorure de méthylmagnésium avec Propanona (Cetona). Source: Gabriel Bolívar via Chemsketch.
Réaction de chlorure de méthylmagnésium avec Propanona (Cetona). Source: Gabriel Bolívar via Chemsketch. Dans cet exemple, la propanone, car il s'agit d'une cétone, se transforme en alcool tertiaire 3-butanol lorsqu'il réagit avec le chlorure de méthylmagnésium.
Exemple 4
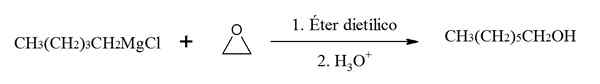 Réaction de bromure de pentilmagnésium avec l'oxyde d'éthylène (époxyde). Source: Gabriel Bolívar via Chemsketch.
Réaction de bromure de pentilmagnésium avec l'oxyde d'éthylène (époxyde). Source: Gabriel Bolívar via Chemsketch. Dans cet exemple, l'oxyde d'éthylène réagit avec le chlorure de pentilmagnésium pour former l'alcool 1-heptanol.
Autres exemples de réactions de réactifs de Grignard
Le bromure d'arilmagnésium et l'éther dietyl réagissent avec un halogénure en vinyle, RCH = CHX ou R2C = chx, pour synthétiser l'étirement. Ce composé est utilisé pour fabriquer des caoutchoucs, des plastiques, des matériaux isolants, des tuyaux, des récipients de nourriture, des pièces de voiture, etc.
Le réactif de Gardard est utilisé dans la production de tamoxifène, médicament utilisé dans le traitement du cancer du sein.
Les références
- Morrison, R. T. Et Boyd, R, n. (1987). Chimie organique. 5e édition. Éditorial Addison-Wesley Inter-American.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. (10e édition.). Wiley Plus.
- Wikipédia. (2020). Réactif de Grignard. Récupéré de: dans.Wikipédia.org
- Clark Jim. (2015). Une introduction aux réactifs de Grignard. Récupéré de: Chemguide.co.ROYAUME-UNI
- Sudha Korwar. (7 septembre 2017). L'application d'une réaction de grignard continu dans la préparation du fluconazole. Chimie Europe. est ce que je.org / 10.1002 / ejoc.201701002
- Seyferth Dietmar. (16 mars 2009). Les réactifs Grignard. Organométalliques , 28, 6, 1598-1605. est ce que je.org / 10.1021 / OM900088Z. American Chemical Society.
- « Les 7 coutumes et traditions des Yaquis les plus importants
- Caractéristiques de régionalisation, types, importance, exemples »

