Caractéristiques des réactions chimiques, pièces, types, exemples

- 1229
- 239
- Jade Duval
Le réactions chimiques Ce sont des changements qui souffrent de la matière dans l'ordre de leurs atomes et se déroulent lorsque deux substances ou composés différents entrent en contact. Dans le processus change qui peut être perçu immédiatement; comme une augmentation de la température, du refroidissement, de la formation de gaz, des éclairs ou des précipitations d'un solide.
Les réactions chimiques les plus courantes passent souvent inaperçues dans la vie quotidienne; Des milliers d'entre eux sont effectués dans notre corps. D'autres, cependant, sont plus visibles, car nous pouvons les effectuer dans la cuisine en sélectionnant des ustensiles et des ingrédients corrects; Par exemple, mélanger le bicarbonate avec du vinaigre, du sucre de fonte dans l'eau ou acidifier le jus du Colorad.
 La réaction du bicarbonate et du vinaigre est un exemple de réaction chimique récurrente dans la cuisine. Source: Kate ter har (https: // www.Flickr.com / photos / katerha / 5703151566)
La réaction du bicarbonate et du vinaigre est un exemple de réaction chimique récurrente dans la cuisine. Source: Kate ter har (https: // www.Flickr.com / photos / katerha / 5703151566) Dans les laboratoires, les réactions chimiques deviennent plus habituelles et courantes; Tous se produisent à l'intérieur du bécher (bécher) ou des flacons d'erlenmeyer. S'ils partagent en commun, aucun n'est simple, car ils cachent les collisions, les pauses de liaison, les mécanismes, la formation de liens, l'énergie et les aspects cinétiques.
Il y a des réactions chimiques si frappantes que les fans et les scientifiques, connaissant la toxicologie des réactifs et certaines mesures de sécurité, les reproduisent à grande échelle dans les actes de démonstration fascinants.
[TOC]
Concept de réaction chimique
Les réactions chimiques ont lieu lorsqu'il y a la rupture d'un lien (ionique ou covalent), de sorte qu'une autre est formée en place; Deux atomes ou un ensemble d'entre eux arrêtent d'interagir fortement pour provoquer de nouvelles molécules. Grâce à cela, les propriétés chimiques d'un composé, sa réactivité, sa stabilité, avec ce qu'elle réagit peut être déterminée.
En plus d'être responsables les réactions chimiques que la question transforme constamment, sans leurs atomes, ils expliquent l'émergence des composés comme nous les connaissons.
Pour que les liens soient brisés, de l'énergie est nécessaire, et lorsque les liens sont formés, il est libéré. Si l'énergie absorbée est supérieure à celle libérée, il est dit que la réaction est endotherme; Nous avons un refroidissement environnant. Alors que si la chaleur libérée est supérieure à l'absorption, ce sera une réaction exothermique; Les environs sont chauffés.
Caractéristiques des réactions chimiques
Cinétique
Les molécules théoriques doivent collaborer entre elles, emportant avec eux suffisamment d'énergie cinétique pour favoriser la rupture d'un lien. Si vos collisions sont lentes ou inefficaces, la réaction chimique est affectée cinétiquement. Cela peut se produire soit par les états physiques des substances, soit par la géométrie ou la structure de la même.
Ainsi, dans une réaction, la matière est transformée en absorbant ou en libérant de la chaleur, tout en souffrant de collisions qui favorisent la formation de produits; Les composants les plus importants de toute réaction chimique.
Conservation de masse
En raison de la loi sur la conservation de la masse, la masse totale de l'ensemble reste constante après une réaction chimique. Ainsi, la somme des masses individuelles de chaque substance est égale à la masse du résultat obtenu.
Changements physiques et / ou changements d'état
La survenue d'une réaction chimique peut être accompagnée d'un changement d'état des composants; c'est-à-dire une variation de l'état solide, liquide ou gazeux du matériau.
Cependant, tous les changements d'état n'impliquent pas une réaction chimique. Par exemple: si l'eau s'évapore en raison de la chaleur, la vapeur d'eau produite après ce changement d'État reste de l'eau.
Variation de couleur
Parmi les attributs physiques résultant d'une réaction chimique, le changement de couleur des réactifs par rapport à la couleur du produit final se démarque.
Ce phénomène est appréciable lors de l'observation de la réaction chimique des métaux avec l'oxygène: lorsqu'un métal est oxydé, il modifie sa couleur caractéristique (or ou argent, selon le cas), pour devenir un ton orange-rougeur, connu sous le nom de rouille.
Libération de gaz
Cette caractéristique se manifeste comme un bouillonnement ou avec l'émission d'odeurs particulières.
Généralement, les bulles apparaissent à la suite de la soumission d'un liquide à des températures élevées, ce qui encourage une augmentation de l'énergie cinétique des molécules qui font partie de la réaction.
Changements de température
Dans le cas où la chaleur est un catalyseur de la réaction chimique, un changement de température sera induit dans le produit final. Par conséquent, l'entrée et la sortie de la chaleur dans le processus peuvent également être une caractéristique des réactions chimiques.
Parties d'une réaction chimique
Réactifs et produits
Une réaction chimique est représentée par une équation du type:
A + B → C + D
Où a et b sont les réactifs, tandis que c et d les produits. L'équation nous dit que l'atome ou la molécule A, réagit avec B pour provoquer des produits C et D. Il s'agit d'une réaction irréversible, car les réactifs ne peuvent pas provenir des produits. Au lieu de cela, la réaction ci-dessous est réversible:
A + B C + D
Il est important de souligner que la masse des réactifs (A + B) doit être égale à la masse des produits (C + D). Sinon, la pâte ne serait pas conservée. De même, le nombre d'atomes pour un élément donné doit être le même avant et après la flèche.
Au-dessus de la flèche indique certaines spécifications de la réaction: la température (Δ), l'incidence du rayonnement ultraviolet (HV), ou le catalyseur utilisé.
Peut vous servir: verre d'horlogeRéaction signifie
En ce qui concerne la vie et les réactions qui se produisent dans notre corps, le milieu de réaction est aqueux (AC). Cependant, les réactions chimiques peuvent être développées dans n'importe quel milieu liquide (éthanol, acide acétique glaciaire, toluène, tétrahydrofurane, etc.) tant que les réactifs sont bien dissous.
Conteneurs ou réacteurs
Les réactions chimiques contrôlées se produisent dans un récipient, que ce soit un simple matériau en verre ou dans un réacteur en acier inoxydable.
Types de réactions chimiques
Les types de réactions chimiques sont basés sur ce qui se passe au niveau moléculaire; Ce que les liens se cassent et comment les atomes finissent par rejoindre. Il est également pris en considération si les espèces gagnent ou perdent des électrons; Même lorsque cela se produit dans la plupart des réactions chimiques.
Voici les différents types de réactions chimiques qui existent.
- Oxydation-réduction (rédox)
Oxydation du cuivre
Dans l'exemple de la patine, une réaction d'oxydation a lieu: le cuivre métallique perd des électrons en présence d'oxygène pour se transformer en son oxyde correspondant.
4cu (s) + o2(g) => cu2Toi)
L'oxyde de cuivre (I) continue de s'oxyder pour donner de l'oxyde de cuivre (II):
2cu2Ou (s) + ou2 => 4cuo (s)
Ce type de réaction chimique où les espèces augmentent ou réduisent leur nombre (ou statut) d'oxydation, est connue sous le nom de réaction d'oxydation et de réduction (rédox).
Le cuivre métallique avec l'état d'oxydation 0, perd d'abord un électron, puis le second (oxyde), tandis que l'oxygène reste (il est réduit):
Cu => cu+ + et-
Cu+ => Cu2+ + et-
SOIT2 + 2E- => 2ème2-
Le gain ou la perte d'électrons peut être déterminé en calculant les nombres d'oxydation pour les atomes dans les formules chimiques de leurs composés résultants.
Pour cu2Ou, on sait que parce que c'est un oxyde, il a un anion ou2-, Ainsi, pour garder les charges neutralisées, chacun des deux atomes de cuivre doit avoir une charge +1. Très similaire se produit avec CUO.
Le cuivre lorsqu'il est oxydé acquiert des nombres d'oxydation positifs; et oxygène, pour être réduit, nombres d'oxydation négatifs.
Fer et cobalt
Des exemples supplémentaires pour les réactions sont présentés ci-dessous. De même, un bref commentaire sera apporté et des modifications des numéros d'oxydation seront spécifiées.
Fecl2 + Cocl3 => Fecl3 + Cocl2
Si les nombres d'oxydation sont calculés, il sera noté que ceux du CL restent avec une valeur constante de -1; Ce n'est pas le cas avec ceux de la foi et du CO.
À première vue, le fer s'est oxydé tandis que le cobalt a été réduit. Comment savoir? Parce que le fer interagit maintenant pas avec deux CL- mais avec trois, étant l'atome de chlore le plus électronégatif que le fer et le cobalt. D'un autre côté, l'inverse arrive à Cobalt: il passe de l'interaction avec trois CL- à deux d'entre eux.
Si le raisonnement précédent n'est pas clair, les équations chimiques du transfert net d'électrons sont écrites:
Foi2+ => Foi3+ + et-
Co3+ + et- => CO2+
Par conséquent la foi2+ Il oxyde, tandis que le CO3+ se réduit.
Iode et manganèse
6 kmno4 + 5ki + 18hcl => 6mncl2 + 5kio3 + 6KCL + 9H2SOIT
Le produit chimique ci-dessus peut sembler compliqué, mais ce n'est pas. Le chlore (Cl-) pas l'oxygène (ou2-) Expérience du gain ou de la perte de leurs électrons. Iode et manganèse, oui.
En considérant uniquement les composés avec de l'iode et du manganèse, vous avez:
Ki => kio3 (Numéro d'oxydation: -1 à +5, perd six électrons)
Kmno4 => MCL2 (Numéro d'oxydation: +7 à +2, gagne cinq électrons)
L'iode s'oxyde, tandis que le manganèse est réduit. Comment savoir sans calculer? Parce que l'iode passe du potassium pour interagir avec trois oxygène (plus électronégatif); Et le manganèse, quant à lui, perd des interactions avec l'oxygène pour être avec le chlore (moins électronégatif).
Le Ki ne peut pas perdre six électrons si le KMNO4 Gagner cinq; C'est pourquoi le nombre d'électrons doit être équilibré dans l'équation:
5 (ki => kio3 + 6E-)
6 (KMNO4 + 5e- => MCL2)
Qui donne naissance à un transfert net de 30 électrons.
La combustion
La combustion est une oxydation vigoureuse et énergique dans laquelle la lumière et la chaleur sont libérées. Généralement, dans ce type de réaction chimique, l'oxygène participe en tant qu'agent oxydant ou de combuté; Tandis que l'agent réducteur est le carburant, qui brûle à la fin du compte.
Là où il y a des cendres, il y avait une combustion. Ceux-ci sont composés de charbon et d'oxydes métalliques; Bien que sa composition dépend logiquement de ce qu'était le carburant. Voici quelques exemples:
C (s) + o2(g) => CO2(g)
2CO (g) + ou2(g) => 2CO2(g)
C3H8(g) + 5o2(g) => 3CO2(g) + 4h2O (g)
Chacune de ces équations correspond à des combustions complètes; c'est-à-dire que tout le carburant réagit avec un excès d'oxygène pour garantir sa transformation complète.
Il convient également de noter que le CO2 et h2Ou ce sont des produits majoritaires gazeux lorsque les corps carbonés brûlent (comme le bois, les hydrocarbures et les tissus animaux). Il est inévitable que certains coaraux alotropes soient formés, en raison d'une insuffisance en oxygène, ainsi que des gaz oxygénés moins tels que le CO et non.
- La synthèse
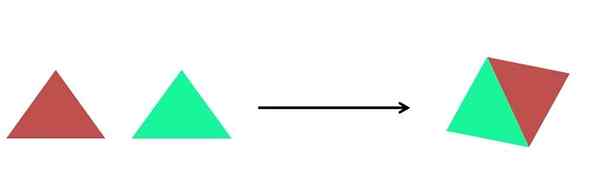
 Représentation graphique d'une réaction de synthèse. Source: Gabriel Bolívar.
Représentation graphique d'une réaction de synthèse. Source: Gabriel Bolívar. Dans l'image supérieure, une représentation très simple est montrée. Chaque triangle est un composé ou un atome, qui se rassemble pour former un seul composé; Deux triangles forment un parallélogramme. Les masses augmentent et les propriétés physiques et chimiques du produit sont, souvent, très différentes de celles de leurs réactifs.
Peut vous servir: enthalpiePar exemple, la combustion de l'hydrogène (qui est également une réaction de rédox), produit de l'oxyde d'hydrogène ou de l'hydrure d'oxygène; mieux connu sous le nom d'Agua:
H2(g) + ou2(g) => 2h2O (g)
En mélangeant les deux gaz, à haute température, brûlant de l'eau gazeuse. Températures refroidies, les vapeurs se condensent pour donner de l'eau liquide. Plusieurs auteurs considèrent cette réaction de synthèse comme l'une des alternatives possibles pour remplacer les combustibles fossiles dans l'obtention d'énergie.
Les liens h-h et o = o sont rompus pour former deux nouveaux liens simples: H-O-H. L'eau, comme on le sait, est une substance inégalée (au-delà du sens romantique), et ses propriétés diffèrent beaucoup de l'hydrogène gazeux et de l'oxygène.
Composés ioniques
La formation de composés ioniques de ses éléments est également un exemple de réaction de synthèse. L'un des plus simples est la formation de halgenuros métalliques des groupes 1 et 2. Par exemple, la synthèse du bromure de calcium:
Ca (s) + br2(L) => cabr2(S)
Une équation générale pour ce type de synthèse est:
M (s) + x2 => Mx2(S)
Coordination
Lorsque le composé formé implique un atome métallique dans la géométrie électronique, il est dit que c'est un complexe. Dans les complexes, les métaux restent unis au ligand par des liaisons covalentes faibles et sont formées par des réactions de coordination.
Par exemple, vous avez le complexe [CR (NH3)6]]3+. Ceci est formé lorsque3+ est en présence de molécules d'ammoniac, NH3, qui agissent comme des ligands chromés:
Croisement3+ + 6nh3 => [CR (NH3)6]]3+
Ci-dessous se trouve l'octaèdre de coordination qui en résulte autour du centre de métal chromé:
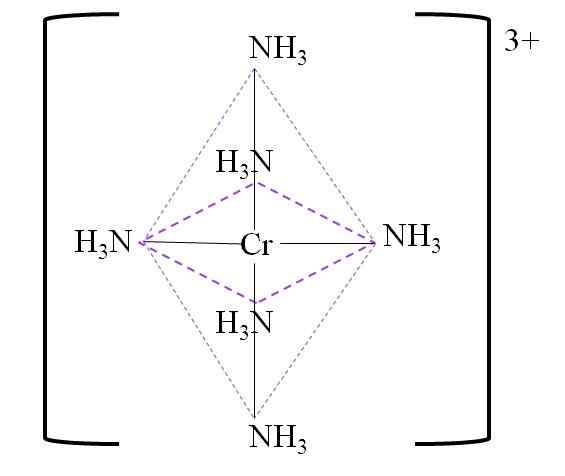 Coordination octaèdre pour le complexe. Source: Gabriel Bolívar.
Coordination octaèdre pour le complexe. Source: Gabriel Bolívar. Notez que la charge de chrome 3+ n'est pas neutralisée dans le complexe. Sa couleur est violet, et c'est pourquoi l'octaèdre est représenté avec cette couleur.
Certains complexes sont plus intéressants, comme dans le cas de certaines enzymes qui coordonnent le fer, le zinc et les atomes de calcium.
- Décomposition
La décomposition devient l'opposé de la synthèse: un composé se divise en un, deux ou trois éléments ou composés.
Par exemple, il y a les trois décompositions suivantes:
2hgo (s) => 2hg (l) + o2(g)
2h2SOIT2(L) => 2h2Ou (l) + o2(g)
H2CO3(AC) => CO2(g) + h2Ou (l)
HGO est un solide rougeâtre qui, par l'action de chaleur, se brise en mercure métallique, liquide noir et oxygène.
Hydrogène Le peroxyde d'hydrogène souffre de décomposition, donnant de l'eau liquide et de l'oxygène.
Et l'acide carbonique, quant à lui, se décompose dans le dioxyde de carbone et l'eau liquide.
Une décomposition plus "sèche" est celle subie par les carbonates métalliques:
Voleur3(s) => Cao (S) + CO2(g)
Volcan de classe
 Meubles Volcano dichromate d'ammonium. Source: наталия [cc by-sa 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]
Meubles Volcano dichromate d'ammonium. Source: наталия [cc by-sa 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] Une réaction de décomposition qui a été utilisée dans les classes de chimie est la décomposition thermique du dichromate d'ammonium (NH4)2Croisement2SOIT7. Ce sel carcanogénal orange (il devrait donc être manipulé avec grand soin), brûle pour libérer beaucoup de chaleur et produire un oxyde chromique solide vert, CR2SOIT3:
(NH4)2Croisement2SOIT7(s) => cr2SOIT3(s) + 4h2Ou (g) + n2(g)
- Déplacement
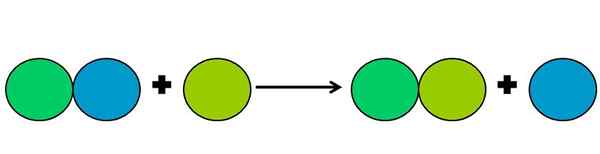 Représentation graphique d'une réaction de déplacement. Source: Gabriel Bolívar.
Représentation graphique d'une réaction de déplacement. Source: Gabriel Bolívar. Les réactions de déplacement sont un type de réaction Rédox dans lequel un élément en déplace un autre dans un composé. L'élément déplacé finit par réduire ou gagner des électrons.
Pour simplifier ce qui précède, l'image supérieure est affichée. Les cercles représentent un élément. On observe que le cercle vert de Lima déplace le bleu, étant à l'extérieur; Mais non seulement cela, mais le cercle bleu est réduit dans le processus, et celui de la lima vert est oxydé.
D'hydrogène
Par exemple, les équations chimiques suivantes pour exposer ce qui précède:
2al (s) + 6hcl (ac) => alcl3(AC) + 3H2(g)
Zr (s) + 2h2Ou (g) => zro2(s) + 2h2(g)
Zn (s) + H2Swin4(AC) => ZNSO4(AC) + H2(g)
Quel est l'élément déplacé pour ces trois réactions chimiques? L'hydrogène, qui est réduit à l'hydrogène moléculaire, H2; passe d'un nombre d'oxydation de +1 à 0. Notez que les métaux en aluminium, en zirconium et en zinc peuvent déplacer les hydrogènes des acides et de l'eau; Tandis que le cuivre, l'argent ou l'or, ne peut pas.
Métaux et halogène
De même, ces deux réactions de déplacement supplémentaires sont disponibles:
Zn (s) + Cuo4(ac) => cu (s) + znso4(AC)
CL2(g) + 2nai (ac) => 2NaCl (ac) + i2(S)
Dans la première réaction, le zinc déplace le cuivre métallique moins actif; Le zinc oxyde pendant que le cuivre est réduit.
Dans la deuxième réaction, en revanche, le chlore, plus élément réactif que l'iode, déplace ces derniers en sel de sodium. Ici se produit en arrière: l'élément le plus réactif est réduit en oxydant l'élément déplacé; Par conséquent, le chlore est réduit l'oxydation en iode.
- Formation de gaz
Dans les réactions, on pourrait voir que plusieurs d'entre eux ont généré des gaz, et donc ils entrent également dans ce type de réaction chimique. De même, les réactions de la section précédente, le déplacement d'hydrogène par un métal actif, sont considérés comme des réactions de formation de gaz.
Peut vous servir: sulfate de sodium Dodecil (SDS): structure, propriétés, utilisationsEn plus de ceux déjà mentionnés, les sulfures métalliques, par exemple, libèrent du sulfure d'hydrogène (qui sent les œufs pourris) lorsque de l'acide chlorhydrique est ajouté:
N / A2S (S) + 2HCl (AC) => 2NACl (AC) + H2S (G)
- Métahesis ou double déplacement
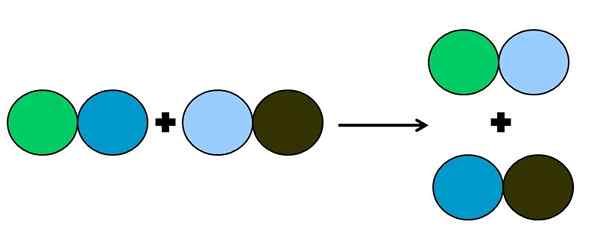 Représentation graphique d'une réaction à double déplacement. Source: Gabriel Bolívar.
Représentation graphique d'une réaction à double déplacement. Source: Gabriel Bolívar. Dans la réaction de la métathèse ou du double déplacement, ce qui se passe est un changement de couple sans transferts d'électrons; c'est-à-dire qu'il n'est pas considéré comme une réaction rédox. Comme on peut le voir dans l'image supérieure, le cercle vert brise le lien avec celui du bleu foncé pour lier le cercle bleu clair.
Précipitation
Lorsque les interactions de l'un des couples sont suffisamment fortes pour surmonter l'effet de solvération des fluides, un précipité est obtenu. Les équations chimiques suivantes représentent les réactions de précipitations:
Agno3(AC) + NaCl (AC) => AGCL (S) + NANO3(AC)
Cacl2(Ac) + na2CO3(ac) => caco3(S) + 2NACl (AC)
Dans la première réaction le CL- déplace le non3- Pour former du chlorure d'argent, AGCL, qui est un précipité blanc. Et dans la deuxième réaction, le CO32- déplace le cl- Pour précipiter le carbonate de calcium.
Acide de base
La plus emblématique des réactions de métathanèse est peut-être celle de l'acide de base de neutralisation. Enfin, deux réactions d'acide de base sont représentées comme exemples:
HCl (AC) + NaOH (AC) => NaCl (AC) + H2Ou (l)
2hcl (ac) + ba (oh)2(Ac) => bacl2(AC) + 2H2Ou (l)
OH- Ils se déplacent vers le CL- Pour former des sels d'eau et de chlorure.
Exemples de réactions chimiques
Ci-dessous, puis il y aura une mention de quelques réactions chimiques avec leurs équations et commentaires respectifs.
Déplacement
Zn (S) + Agno3(ac) → 2ag (s) + zn (non3)2(AC)
Le zinc déplace l'argent dans son sel de nitrate: il réduit Ag+ A AG. En conséquence, l'argent métallique commence à précipiter au milieu, observé à un microscope dont les arbres sans argent. D'un autre côté, le nitrate est combiné avec des ions Zn2+ résultant à former du nitrate de zinc.
Neutralisation
Voleur3(s) + 2hcl (ac) → cacl2(AC) + H2Ou (l) + co2(g)
L'acide chlorhydrique neutralise le sel de carbonate de calcium pour produire du sel, du chlorure de calcium, de l'eau et du dioxyde de carbone. Le CO2 bulles et est détectée dans l'eau. Ce bubb3.
NH3(g) + HCl (g) → NH4CL (S)
Dans cette deuxième réaction, les vapeurs HCl neutralisent l'ammoniac gazeux. Le chlorure de saline à l'ammonium, NH4Cl, se forme comme une fumée blanchâtre (image inférieure), car elle contient des particules très fines en suspension dans l'air.
 Réaction d'entraînement au chlorure d'ammonium. Source: Adam Rędzikowski [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]
Réaction d'entraînement au chlorure d'ammonium. Source: Adam Rędzikowski [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] Double déplacement
Agno3(AC) + NaCl (AC) → AGCL (S) + NANO3(AC)
Dans une réaction à double déplacement, il y a un échange de "couples". L'argent change un couple avec du sodium. Le résultat est que le nouveau sel, le chlorure d'argent, l'agcl, précipite comme un solide laiteux.
Rédox
 Dans la réaction chimique aboyant la chaleur du chien, le son et la lumière bleue sont libérés. Source: Maxim Bilovitskiy via Wikipedia.
Dans la réaction chimique aboyant la chaleur du chien, le son et la lumière bleue sont libérés. Source: Maxim Bilovitskiy via Wikipedia. Il y a d'innombrables réactions rédox. L'un des plus impressionnants est celui de Barkin Dog:
8 N2Ou (g) + 4 cs2(L) → s8(s) + 4 co2(g) + 8 n2(g)
L'énergie libérée est tellement lorsque les trois produits stables se forment, qu'un flash bleuâtre (image supérieure) et une augmentation retentissante de la pression causée par les gaz sont originaires (CO2 et n2).
Et en plus, tout cela est accompagné d'un son très fort similaire à l'aboiement d'un chien. Le soufre produit, s8, Couvrir jaune les murs internes du tube.
Quelle espèce est réduite et qui est oxydée? En règle générale, les éléments ont un numéro d'oxydation 0. Par conséquent, le soufre et l'azote dans les produits doivent être l'espèce qui a gagné ou perdu des électrons.
Le soufre oxydé (électrons perdu), car il avait le numéro d'oxydation -2 dans le CS2 (C4+S22-):
S2- → S0 + 2E-
Tandis que l'azote a été réduit (a gagné des électrons), car il avait un nombre d'oxydation +1 en n2Ou (n2+SOIT2-):
2n+ + 2e → n0
Exercices de réactions chimiques résolues
- Exercice 1
Quel sel précipite dans la réaction suivante en milieu aqueux?
N / A2S (ac) + feso4(AC) →?
En règle générale, tous les sulfures, à l'exception des métaux alcalins et ammonium, précipitent en milieu aqueux. Un double déplacement se produit: le fer se lie au sulfure et au sodium avec du sulfate:
N / A2S (ac) + feso4(ac) → fes (s) + na2Swin4(AC)
- Exercice 2
Quels produits obtiendrons-nous de la réaction suivante?
Timbre3)2 + Ca (oh)2 →?
L'hydroxyde de calcium n'est pas très soluble dans l'eau; Mais l'ajout de nitrate de cuivre aide à le solubiliser car il réagit pour former son hydroxyde correspondant:
Timbre3)2(ac) + ca (oh)2(Ac) → Cu (OH)2(s) + ca (Non3)2(AC)
Le cu (oh)2 Il est reconnu instantanément pour être un précipité bleu.
- Exercice 3
Quel sel se produira dans la prochaine réaction de neutralisation?
Al (oh)3(s) + 3hcl (ac) → ¿¿?
L'hydroxyde d'aluminium se comporte comme une base réagissant avec l'acide chlorhydrique. Dans une réaction de neutralisation acide-base (à partir de la lowry brnsted), de l'eau est toujours formée, donc l'autre produit doit être du chlorure d'aluminium, alcl3:
Al (oh)3(s) + 3hcl (ac) → alll3(AC) + 3H2SOIT
Cette fois l'alcl3 Il ne précipite pas car il s'agit d'un sel (dans une certaine mesure) soluble dans l'eau.
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Ana Zita. (18 novembre 2019). Réactions chimiques. Récupéré de: Todamaateria.com
- Kashyap vyas. (23 janvier 2018). 19 réactions chimiques cool que la science provale est falcinante. Récupéré de: Intéressant Engineering.com
- Beautifulchemistry.net (s.F.). Réaction. Récupéré de: BeautifulChemistry.filet
- Wikipédia. (2019). Réaction chimique. Récupéré de: dans.Wikipédia.org

