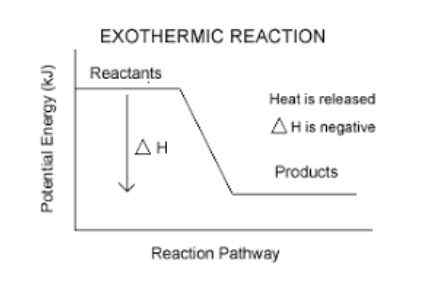
Réaction exothermique
- 1315
- 214
- Raphaël Meyer
Nous expliquons quelles sont les réactions exothermiques, leurs caractéristiques, leurs différences avec les réactions endothermiques et donnent plusieurs exemples
Quelles sont les réactions exothermiques?
Le réactions exothermiques Ce sont des réactions chimiques qui libèrent de l'énergie sous forme de chaleur. Le mot exothermique est formé par "Exo" ce qui signifie "sortir", et "thermos" ce qui signifie la chaleur, donc la "réaction exothermique" signifie littéralement, la réaction dans laquelle la chaleur s'éteint.
Ces réactions sont très courantes et nous pouvons les trouver partout, de nos maisons aux cellules qui font partie de notre corps.
À la maison, nous pouvons les trouver dans la cuisine lorsque le gaz brûle dans la corne pour cuire notre nourriture. Nous les trouvons également à l'intérieur des moteurs de voiture lorsqu'ils brûlent du carburant.
 Un exemple de réaction exothermique
Un exemple de réaction exothermique D'un autre côté, les réactions exothermiques sont essentielles à la vie, car elles fournissent aux cellules l'énergie dont ils ont besoin pour vivre, grandir et reproduire.
Caractéristiques des réactions exothermiques
Ils libèrent de l'énergie sous forme de chaleur
C'est la principale caractéristique qui en fait des réactions exothermiques.
L'énergie libérée vient des mêmes réactifs
Chaque réaction chimique nécessite une certaine énergie d'activation pour se produire. Dans le cas des réactions exothermiques, cette énergie provient des mêmes réactifs lorsqu'il est transformé en produits.
Les réactions exothermiques Les produits sont toujours plus stables que les réactifs.
Les réactifs en devenant des produits, perdent une partie de leur énergie sous forme de chaleur. Pour cette raison, les produits restent toujours moins d'énergie que les réactifs, ce qui les rend plus stables.
Ils ont une variation d'enthalpie négative.
C'est un moyen facile de savoir si une réaction est exothermique ou non. Toute réaction qui a un AH (lire delta h) négatif, sera exothermique.
- Par exemple, La réaction de combustion du butane (le gaz que nous brûlons dans la cuisine) a une variation d'enthalpie de -11.823 kcal / mol. Par conséquent, c'est une réaction exothermique.
Ils n'ont besoin que d'un déclencheur pour se produire dans la plupart des cas.
De nombreuses réactions exothermiques n'ont besoin que de quelque chose qui leur donne suffisamment d'énergie pour commencer. Après cela, la même chaleur qu'ils libérent suffit pour que la réaction marche.
- Par exemple, En brûlant du gaz, une seule étincelle est nécessaire, puis la flamme continue de s'allumer jusqu'à ce que le gaz soit terminé.
Différences entre les réactions exothermiques et les réactions endothermiques
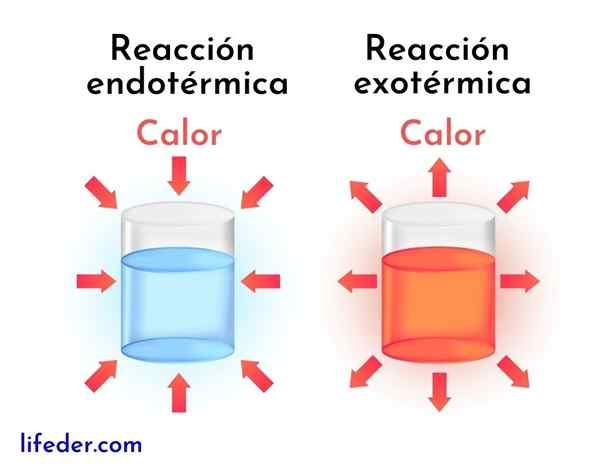
Les réactions exothermiques sont l'opposé des réactions endothermiques. Dans ce dernier, les réactifs absorbent l'énergie sous forme de chaleur au lieu de le libérer, comme dans les réactions exothermiques.
Ensuite, les principales différences entre les réactions exothermiques et endothermiques sont présentées:
Réactions exothermiques | Réactions endothermiques |
Ils libèrent de l'énergie sous forme de chaleur. | Ils absorbent l'énergie sous forme de chaleur. |
Ils ont une variation d'enthalpie négative, c'est-à-dire dh<0. | Ils ont une variation d'enthalpie positive, c'est-à-dire dh> 0. |
Ils ont tendance à augmenter la température environnante. | Ils ont tendance à réduire la température ou à refroidir. |
L'énergie qui maintient la réaction marche provient des mêmes réactifs. | L'énergie qui maintient la réaction marche vient de l'environnement. |
Des produits plus stables sont toujours obtenus avec moins d'énergie. | Les produits moins stables sont toujours obtenus avec un niveau d'énergie plus élevé. |
Exemples de réactions exothermiques
La combustion du gaz de cuisine
Dans la plupart des maisons du monde, le gaz utilisé pour cuire les aliments est le butane, qui a la formule moléculaire C4Hdix. Cet hydrocarbure est brûlé avec l'oxygène de l'air au moyen de la réaction de combustion suivante libérant de grandes quantités de chaleur:
Peut vous servir: microscope simple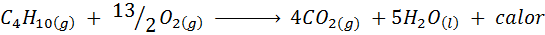
L'explosion de la dynamite
La dynamite contient un explosif appelé nitroglycérine (c3H5N3SOIT9). Ce composé se décompose très violemment en libérant de grandes quantités de chaleur, ce qui provoque une grande explosion. La réaction chimique est:
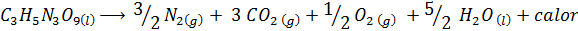
Cette réaction a un ΔH = -368 kcal⁄mol, C'est donc une réaction exothermique.
Combustion spontanée du phosphore blanc
L'élément de phosphore (P) peut être trouvé comme phosphore rouge ou phosphore blanc. Phosphore blanc. La réaction est:
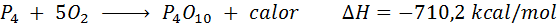
Respiration cellulaire
La respiration cellulaire est une réaction chimique exothermique qui consiste à l'oxydation des aliments que nous mangeons. La chaleur libérée par cette réaction est utilisée par les cellules pour effectuer des réactions chimiques endothermiques sans fin qui nécessitent une énergie pour se produire.
Les feux d'artifice
Les feux d'artifice contiennent une poudre à canon noire comme composant explosif principal. La poudre à canon est un mélange qui contient du nitrate de potassium, du graphite et du carbone de soufre qui réagissent entre eux par une réaction exothermique. La chaleur que cette réaction libère génère la large gamme de couleurs que nous voyons dans le ciel lorsque les feux d'artifice explosent.
Le tampon thermique chimique
Les coussinets thermiques sont utilisés comme compresses chaudes pour soulager les blessures sportives. Ceux-ci se composent d'un sac scellé contenant de l'eau et un chimiste à l'intérieur d'un petit tube. Lorsque le tube est cassé, le chimiste est mélangé avec l'eau produisant une réaction chimique exothermique qui chauffe le coussin.
Réaction métallique de sodium avec l'eau
Le sodium (NA) est un métal alcalin très réactif qui, lorsqu'il entre en contact avec de l'eau, réagit violemment en libérant beaucoup de chaleur et d'hydrogène gazeux. La réaction est:
Il peut vous servir: méthodes de séparation des mélanges hétérogènes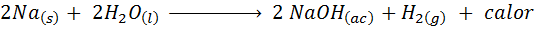
Cette réaction libère 1900 calories pour chaque gramme de Na qui réagit avec l'eau. Cela signifie que 1 gramme de sodium serait suffisant pour chauffer 3 tasses à café moyen.
Dissolution du détergent
C'est une réaction que n'importe qui peut vivre dans sa maison. Lorsque vous prenez une poignée de détergent à épousseter pour laver les vêtements et le mouiller avec un peu d'eau, la main se sentira immédiatement chaude. En effet, le processus de dissolution du détergent dans l'eau est exothermique.
La réaction trimita
Le Termita est un mélange d'aluminium sous la forme d'une très fine poudre et d'un oxyde d'un autre métal comme le fer. Après une étincelle, la réaction qui se produit est:
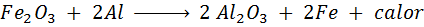
Cette réaction libère tellement de chaleur, qui est capable de faire fondre le fer et est beaucoup utilisée pour souder les trains.
Condensation de l'eau
Pour toutes les substances, les changements de phase gazeuse (condensation), le liquide à solide (solidification) et le gaz solide (dépôt), relâchent toujours la chaleur et sont donc des processus exothermiques. Dans le cas de l'eau, la condensation de seulement 18 grammes d'eau libère environ 10.000 calories, ce qui suffit pour chauffer 15 petites tasses à café.
Les références
- Chang, R. et Goldsby, k. (2014). Chimie. 11e édition. New York: McGraw-Hill Education.
- Réaction exothermique (2020, 19 décembre). À Wikipedia. Pris à partir de.Wikipédia.org
- Holmes, W. S. (1963). Chaleur de la combustion du phosphore et des enthalpies de formation de p4o10 et h3po4. Faraday Soc. 58. 1916-1925. Doi: 10.1039 / TF9625801916.
- Prada P. de., F. Toi. (2014). Fixer, Rockets et beaucoup de chimie. Éducation chimique. 44-51. Doi: 10.2436/20.2003.02.134
- Réaction de thermite. Université du Minnesota (Département de chimie). Tiré de Chem.Umn.Édu
- « Gestion de l'environnement
- Histoire de la rivière Llobregat, caractéristiques, tournée, affluents, flore »

